2.2: Los tamaños y formas de las moléculas orgánicas
- Page ID
- 72475
El tamaño y la forma de las moléculas forman parte tanto de la estructura molecular como el orden en el que se unen los átomos componentes. Contrariamente a la impresión que puede obtener de las fórmulas estructurales, las moléculas complejas no son planas y sin forma, sino que tienen disposiciones espaciales bien definidas que están determinadas por las longitudes y el carácter direccional de sus enlaces químicos. No es fácil visualizar las posibles disposiciones de los enlaces en el espacio y es muy útil tener algún tipo de modelo mecánico que refleje la geometría molecular, incluyendo al menos una aproximación a las longitudes relativas de los enlaces. Modelos “Bola y Palo” como los utilizados por Paterno (Sección 1-1D) llenan este propósito de manera admirable.
Ángulos de unión y modelos de bola y varilla
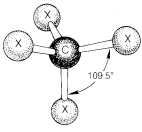
Está bien establecido que el átomo de carbono normal forma sus cuatro enlaces simples en compuestos del tipo de\(CX_4\) manera que los cuatro átomos unidos se encuentran en las esquinas de un tetraedro regular. \(X-C-X\)Los ángulos de unión son\(109.5^\text{o}\) y este valor es el ángulo de valencia “normal” del carbono. Para muchos propósitos, los modelos de bola y varilla de compuestos orgánicos dan información útil sobre las relaciones espaciales de los átomos, y para\(CX_4\) los ángulos entre barras se establecen en\(109.5^\text{o}\) (Figura 2-1). Las moléculas orgánicas resisten fuertemente las fuerzas de deformación que alteran sus ángulos de valencia respecto a los valores normales. Por lo tanto, los modelos de bola y varilla corresponden mejor al comportamiento de las moléculas reales si los conectores que representan enlaces simples están hechos para ser bastante rígidos.
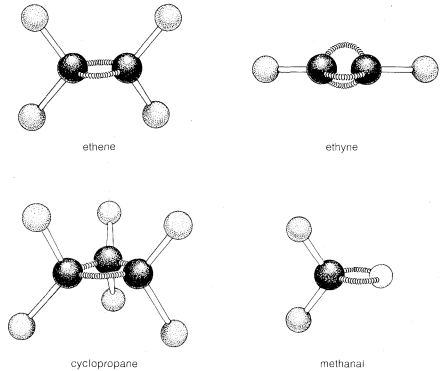
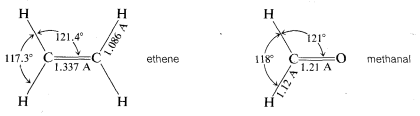
Mientras que el metano\(CH_4\),, es tetraédrico, eteno,\(C_2H_4\), no lo es. De acuerdo con las mejores mediciones físicas disponibles, los seis átomos de eteno se encuentran en un solo plano y los ángulos de\(H-C-H\) enlace lo son\(117.3^\text{o}\). Metanal (formaldehído) también es una molécula plana con un ángulo de\(H-C-H\) enlace de\(118^\text{o}\).
Ethyne\(C_2H_2\),, se ha establecido experimentalmente como una molécula lineal; es decir, el ángulo de\(H-C-C\) enlace es\(180^\text{o}\):
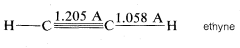
Las unidades estructurales que tienen ángulos de\(C-C-C\) valencia sustancialmente menores que el valor tetraédrico incluyen enlaces dobles y triples, y anillos pequeños como el ciclopropano. Se requieren varios enlaces doblados para construir modelos de compuestos que contienen estas unidades. Curiosamente, tales compuestos son mucho menos estables y más reactivos que otras moléculas similares para las cuales se pueden construir modelos con barras rectas en ángulos tetraédricos.
Longitudes de unión y modelos de llenado de espacio
La longitud de un enlace químico es la distancia promedio entre los núcleos de dos átomos unidos, independientemente de dónde se encuentren los electrones de unión. La unidad de longitud habitual es el angstrom\(^1\) (\(\text{A} = 10^{-10} \: \text{m}\)), y las mediciones a menudo se pueden hacer con una precisión de\(0.001 \: \text{A}\) mediante el uso de las técnicas de espectroscopia molecular, difracción de rayos X (para sólidos cristalinos) y difracción de electrones (para compuestos volátiles). Las longitudes de los enlaces varían considerablemente con la estructura y dependen de la identidad de ambos átomos, el tipo de enlace (simple, doble o triple) y la naturaleza de otros átomos o grupos unidos a los dos átomos en cuestión. Estos efectos son evidentes en los datos del Cuadro 2-1, que enumera las longitudes de enlace en varios compuestos orgánicos simples. Los enlaces múltiples, dobles o triples, son claramente más cortos que los enlaces simples, y se puede afirmar como una observación general que cuantos más electrones se unan en un enlace dado, más corto (y más fuerte) es el enlace. Las longitudes de\(C-C\) los enlaces simples también varían significativamente dependiendo de qué otros átomos o grupos estén unidos a los carbonos. Así, el Cuadro 2-1 muestra que\(C-C\) los enlaces simples se vuelven progresivamente más cortos a medida que aumenta el número de enlaces múltiples o átomos electronegativos unidos a los carbonos.
Aunque los modelos moleculares no pueden representar las variaciones sutiles en las longitudes de enlace y los ángulos de enlace que exhiben las moléculas reales, la mayoría de los tipos de modelos moleculares disponibles comercialmente intentan reproducir longitudes de enlace relativas con cierto grado de realidad. En el tipo de bola y varilla, las barras generalmente vienen en varias longitudes para simular diferentes tipos de enlaces;\(C-H\) los enlaces generalmente se escalan para representar\(1.1 \: \text{A}\),\(C-C\) los enlaces para ser\(1.54 \: \text{A}\)\(C=C\) y\(C \equiv C\) para ser correspondientemente más cortos. En algunos conjuntos de modelos los enlaces se pueden cortar a cualquier longitud deseada.
Si bien los modelos de moléculas de bola y varilla son muy útiles para visualizar las posiciones relativas de los átomos en el espacio, son insatisfactorios siempre que también queremos mostrar cuán grandes son los átomos. En realidad, los radios atómicos son tan grandes en relación con las longitudes de los enlaces químicos que cuando se construye un modelo de una molécula como el cloruro de metilo con radios atómicos y longitudes de enlace, ambos a escala, los enlaces que conectan los átomos no son claramente evidentes. Ninguno-
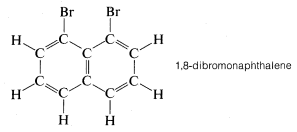
Como veremos, tal hacinamiento tiene muchas consecuencias químicas.
Idealmente, un modelo debe reflejar no solo el tamaño y la forma de la molécula que representa sino también la flexibilidad de la molécula. Con esto queremos decir que
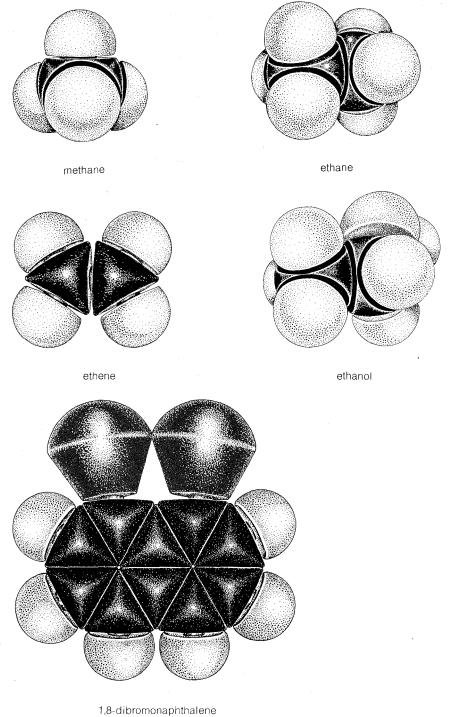
debe simular el tipo de movimientos disponibles para la molécula, particularmente la rotación de enlaces. Por ejemplo, se sabe que la rotación normalmente ocurre alrededor de enlaces simples en compuestos de cadena abierta pero se restringe alrededor de dobles enlaces. Los movimientos de este tipo se demuestran fácilmente con los modelos de bola y palo, pero no son del todo obvios con el tipo de relleno de espacio. Por esta razón, los modelos de bola y varilla o su equivalente son generalmente útiles que los modelos de relleno de espacio para visualizar estructuras y las posiciones de los átomos entre sí.
\(^1\)La unidad de angstrom probablemente será reemplazada eventualmente por el nanómetro (\(1 \: \text{nm} = 10^{-9} \: \text{m} = 10 \: \text{A}\)).
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


