8.1: Preludio a las reacciones de sustitución y eliminación nucleofílicas
- Page ID
- 73177
Las reacciones de sustitución implican la sustitución de un átomo o grupo\(\left( \ce{X} \right)\) por otro\(\left( \ce{Y} \right)\):
\[\ce{RX} + \ce{Y} \rightarrow \ce{RY} + \ce{X}\]
Ya hemos descrito un tipo muy importante de reacción de sustitución, la halogenación de alcanos (Sección 4-4), en la que un átomo de hidrógeno es reemplazado por un átomo de halógeno (\(\ce{X} = \ce{H}\),\(\ce{Y} =\) halógeno). La cloración de 2,2-dimetilpropano es un ejemplo:
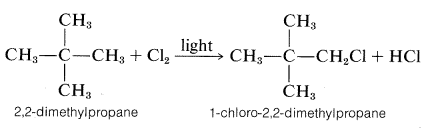
Las reacciones de este tipo proceden por mecanismos de cadena radical en los que los enlaces se rompen y se forman por átomos o radicales como intermedios reactivos. Este modo de ruptura de enlaces, en el que un electrón va con\(\ce{R}\) y el otro con\(\ce{X}\), se llama escisión de enlace homolítico:
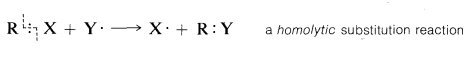
Hay un gran número de reacciones, que suelen ocurrir en solución, que no involucran átomos ni radicales sino que involucran iones. Se producen por escisión heterolítica en oposición a la escisión homolítica de los enlaces de pares de electrones. En la escisión de enlaces heterolíticos, se puede considerar que el par de electrones va con uno u otro de los grupos\(\ce{R}\) y\(\ce{X}\) cuando el enlace se rompe. Como ejemplo,\(\ce{Y}\) es un grupo tal que tiene un par de electrones no compartidos y además es un ion negativo. Una reacción de sustitución heterolítica en la que va el par de\(\ce{R} \colon \ce{X}\) unión\(\ce{X}\) conduciría a\(\ce{RY}\) y\(\colon \ce{X}^\ominus\),
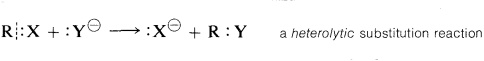
Una reacción de sustitución específica de este tipo es la del clorometano con ión hidróxido para formar metanol:
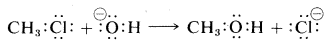
En este capítulo, discutiremos las reacciones de sustitución que proceden por mecanismos iónicos o polares en los que los enlaces se escinden heterolíticamente. También discutiremos las reacciones de eliminación relacionadas con el mecanismo que resultan en la formación de múltiples enlaces carbono-carbono:
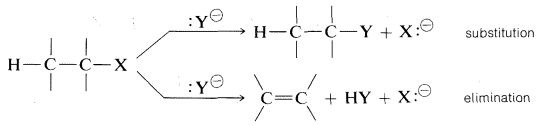
Estas reacciones a menudo están profundamente influenciadas por variaciones aparentemente menores en la estructura de los reactivos, en el disolvente o en la temperatura. Nuestro propósito es mostrar cómo se pueden entender estas reacciones y cómo se pueden usar para preparar otros compuestos orgánicos útiles. Pero primero será útil introducir los conceptos de reactivos nucleofílicos y electrofílicos, y considerar\(\Delta H\) los valores para la ruptura de enlaces heterolíticos.
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


