8.2: Clasificación de Reactivos como Electrofilos y Nucleófilos. Ácidos y Bases
- Page ID
- 73164
Para entender las reacciones iónicas, necesitamos ser capaces de reconocer si un reactivo en particular actuará para adquirir un par de electrones o para donar un par de electrones. Se dice que los reactivos que adquieren un par de electrones en reacciones químicas son electrofílicos (“amantes de los electrones”). Podemos imaginar esto de manera general como una ruptura del enlace heterolítico del compuesto\(X:Y\) por un electrófilo\(E\) tal que\(E\) se une a\(Y\) por el par de electrones del\(XY\) enlace. Por lo tanto
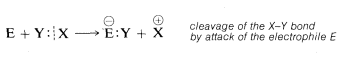
Se dice que los reactivos que donan un par de electrones en reacciones químicas son nucleofílicos (“amantes del núcleo”). Así también se puede considerar que el\(X:Y\) enlace está roto por el nucleófilo\(Nu:\), que dona su par de electrones a\(X\) mientras\(Y\) deja como\(Y:^\ominus\) con los electrones del\(X:Y\) enlace:
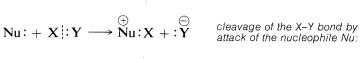
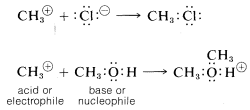
Así, por definición, los electrófilos son aceptores de pares de electrones y los nucleófilos son donantes de pares de electrones. Estas definiciones corresponden estrechamente a definiciones utilizadas en la teoría generalizada de ácidos y bases propuesta por G. N. Lewis (1923). Según Lewis, un ácido es cualquier sustancia que pueda aceptar un par de electrones, y una base es cualquier sustancia que pueda donar un par de electrones para formar un enlace covalente. Por lo tanto, los ácidos deben ser electrófilos y las bases deben ser nucleófilos. Por ejemplo, el catión metilo puede ser considerado como un ácido de Lewis, o un electrófilo, porque acepta electrones de reactivos como el ion cloruro o metanol. A su vez, debido a que el ion cloruro y el metanol donan electrones al catión metílico se clasifican como bases de Lewis, o nucleófilos:
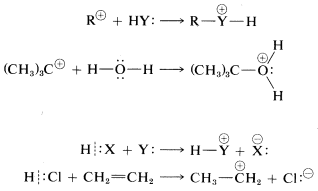
El concepto generalizado de Lewis de ácidos y bases también incluye reacciones comunes de transferencia de protones. \(^1\)Así, el agua actúa como base porque uno de los pares de electrones sobre el oxígeno puede abstraer un protón de un reactivo como el fluoruro de hidrógeno:
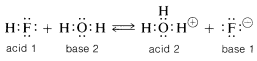
Alternativamente, el ion hidronio (\(H_3O^\oplus\)) es un ácido porque puede aceptar electrones de otro reactivo (por ejemplo, ion fluoruro) donando un protón.
Un donante de protones puede clasificarse como electrófilo y un aceptor de protones como nucleófilo. Por ejemplo, el cloruro de hidrógeno puede transferir un protón a eteno para formar el catión etílico. Por lo tanto, el cloruro de hidrógeno funciona como el electrófilo, o ácido, y el eteno funciona como el nucleófilo, o base:
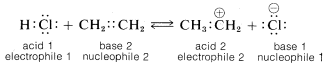
¿Cuál es entonces la diferencia entre un ácido y un electrófilo, o entre una base y un nucleófilo? No hay gran diferencia hasta que intentemos utilizar los términos en un sentido cuantitativo. Por ejemplo, si nos referimos a la fuerza ácida, o acidez, esto significa la posición de equilibrio en una reacción ácido-base. La constante de equilibrio\(K_a\) para la disociación de un ácido\(HA\), o el\(pK_a\), es una medida cuantitativa de la fuerza ácida. Cuanto mayor sea el valor de\(K_a\) o cuanto menor sea el\(pK_a\), más fuerte es el ácido.
Un resumen de las relaciones entre\(K_a\) y\(pK_a\) siguientes, donde las cantidades entre paréntesis son concentraciones:
![Arriba: H A más H 2 O está en equilibrio con H 3 O catión más A menos. Abajo: K A es igual a [H 3 O catión] veces [anión A] sobre [H A]. Texto: Observe que la concentración de agua no aparece en esta expresión; es el disolvente y su concentración es grande y constante.](https://chem.libretexts.org/@api/deki/files/68646/Roberts_and_Caserio_Screenshot_8-1-6.png)
o
![Log negativo K A es igual a - log [H 3 O más] más log [H A] sobre [anión A].](https://chem.libretexts.org/@api/deki/files/68647/Roberts_and_Caserio_Screenshot_8-1-7.png)
Por definición,\(-\text{log} \: K_a = pK_a\) y\(-\text{log} \: \left[ H_3O^\oplus \right] = pH\); por lo tanto
![P K A es igual a P H más log [H A] sobre [anión A].](https://chem.libretexts.org/@api/deki/files/68648/Roberts_and_Caserio_Screenshot_8-1-8.png)
o
![P K A es igual a P H más log [ácido no disociado] sobre [anión del ácido]. Texto: esto a veces se conoce como la ecuación de Henderson-Hasselbalch.](https://chem.libretexts.org/@api/deki/files/68649/Roberts_and_Caserio_Screenshot_8-1-9.png)
Sin embargo, al referirnos a la fuerza de los reactivos como electrófilos o nucleófilos generalmente no nos referimos a equilibrios químicos sino a velocidades de reacción. Un buen nucleófilo es un reactivo que reacciona rápidamente con un electrófilo particular. En contraste, un nucleófilo pobre reacciona solo lentamente con el mismo electrófilo. En consecuencia, no se debe dar por sentado que existe un paralelo entre la acidez o basicidad de un reactivo y su reactividad como electrófilo o nucleófilo. Por ejemplo, es incorrecto suponer que las resistencias de una serie de bases, en solución acuosa\(B:\), necesariamente serán paralelas a sus nucleofilicidades hacia un electrófilo de carbono, como el cloruro de metilo:
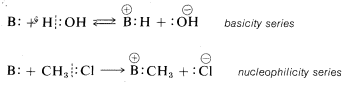
En lo que sigue nos ocuparemos de las tasas de reacciones iónicas bajo condiciones de no equilibrio. Utilizaremos el término nucleofílico repetidamente y queremos que entiendas que un nucleófilo es cualquier reactivo neutro o cargado que suministre un par de electrones, ya sea enlazando o no enlazando, para formar un nuevo enlace covalente. En las reacciones de sustitución el nucleófilo suele ser un anión,\(Y:^\ominus\), o una molécula neutra,\(Y:\) o\(HY:\). El funcionamiento de cada uno de estos se ilustra en las siguientes ecuaciones para reacciones del compuesto general\(RX\) y algunos ejemplos específicos:
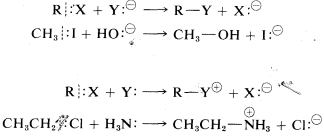
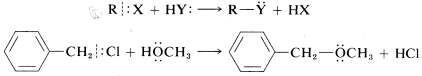
Un electrófilo es cualquier reactivo neutro o cargado que acepta un par de electrones (de un nucleófilo) para formar un nuevo enlace. En las reacciones de sustitución precedentes, el electrófilo es\(RX\). El electrófilo en otras reacciones puede ser un catión de carbono o un donante de protones, como en los siguientes ejemplos:
\(^1\)El concepto de un ácido como donante de protones y una base como aceptor de protones se debe a Bronsted y Lowry (1923). Antes de este tiempo, los ácidos y bases generalmente se definían como sustancias que funcionaban formando\(H^\oplus\) o\(OH^\ominus\) en soluciones acuosas. El concepto Bronsted-Lowry fue importante porque liberó fenómenos ácido-base de los confines de los solventes que contienen agua al centrar la atención en las transferencias de protones en lugar de la formación de\(H^\oplus\) o\(OH^\ominus\). El concepto de Lewis de ácidos y bases generalizados amplió aún más la imagen al mostrar la relación entre las transferencias de protones y las reacciones donde un aceptor de pares de electrones se transfiere de un donante de pares de electrones a otro.
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


