8.6: Estereoquímica de\(S_N2\) Reactions
- Page ID
- 73190
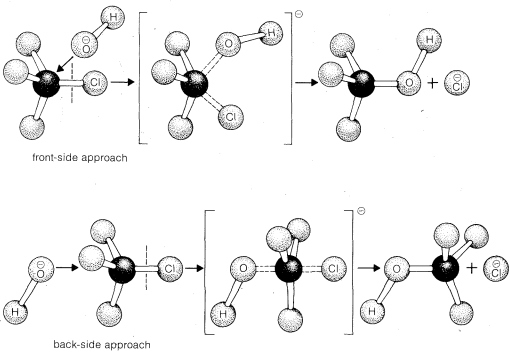
Hay dos formas sencillas en las que la\(\text{S}_\text{N}2\) reacción del cloruro de metilo podría ocurrir con el ión hidróxido. Estos difieren en la dirección de aproximación de los reactivos (Figura 8-1). El ion hidróxido podría atacar el clorometano en la parte frontal del carbono donde se une el cloro o, alternativamente, el ion hidróxido podría acercarse al carbono en el lado opuesto al cloro en lo que se llama enfoque de la parte posterior. En cualquier caso, la realización del\(C-O\) enlace es esencialmente simultánea con la ruptura del\(C-Cl\) enlace. La diferencia es que para el mecanismo de la parte posterior el carbono y los hidrógenos unidos se vuelven planos en el estado de transición.
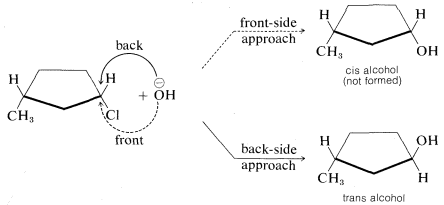
Las consecuencias estereoquímicas de los desplazamientos frontales y traseros son diferentes. Con compuestos cíclicos, los dos tipos de desplazamiento conducen a diferentes productos. Por ejemplo, una\(\text{S}_\text{N}2\) reacción entre el cloruro de cis-3-metilciclopentilo y el ion hidróxido daría el alcohol cis por enfoque frontal pero el alcohol trans por enfoque posterior. El producto real es el alcohol trans, del cual sabemos que la reacción se produce por desplazamiento de la parte posterior:
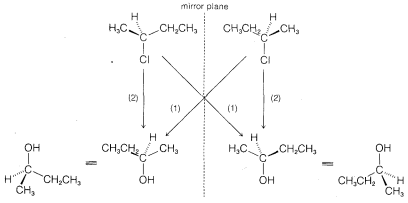
desplazamiento para dar 2-butanol con la configuración invertida. Estudios similares de una amplia variedad de desplazamientos han establecido que las\(\text{S}_\text{N}2\) reacciones proceden invariablemente con la inversión de la configuración a través del ataque de la parte posterior. Este curso estereoquímico comúnmente se conoce como la inversión Walden. \(^5\)A continuación se presenta una imagen orbital del estado de transición de una\(\text{S}_\text{N}2\) reacción que conduce a la inversión de la configuración:
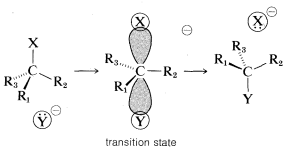
\(^5\)La primera observación documentada de que los compuestos ópticamente activos podrían reaccionar para dar productos que tienen la configuración opuesta fue realizada por P. Walden, en 1895. Las implicaciones no se entendieron, sin embargo, hasta que los mecanismos de sustitución nucleofílica fueron dilucidados en la década de 1930, en gran parte a través del trabajo de E. D. Hughes y C. K. Ingold, quienes establecieron que\(\text{S}_\text{N}2\) las sustituciones dan productos de configuración invertida.
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


