8.5: Mecanismos de las reacciones de sustitución nucleofílica
- Page ID
- 73233
Se pueden escribir dos mecanismos simples para la reacción del clorometano con ión hidróxido en solución acuosa que difieren en el momento de la ruptura del enlace en relación con la fabricación de enlaces. En el primer mecanismo,\(A\), la reacción global es el resultado de dos etapas, la primera de las cuales implica una lenta disociación del clorometano a carbocatión de metilo solvatado\(^4\) e ion cloruro solvatado. La segunda etapa implica una reacción rápida entre el carbocatión y el ion hidróxido (o agua) para producir metanol.
Mecanismo\(A\):
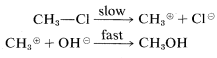
o
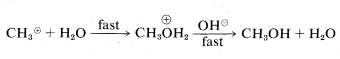
En el segundo mecanismo,\(B\), la reacción procede en un solo paso. El ataque del ion hidróxido al carbono ocurre simultáneamente con la pérdida de ion cloruro; es decir, el enlace carbono-oxígeno se forma a medida que se rompe el enlace carbono-cloro:
Mecanismo\(B\):
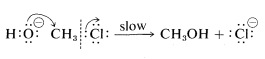
Ambos mecanismos son importantes en las reacciones de desplazamiento de compuestos alquílicos, aunque el clorometano parece reaccionar solo por Mecanismo\(B\). Ahora discutiremos los criterios para distinguir entre los mecanismos concertados y los mecanismos paso a paso.
Cinética de los Mecanismos de Sustitución
De los dos mecanismos,\(A\) requiere que la velocidad de reacción esté determinada únicamente por la velocidad del primer paso (cf. discusión anterior en la Sección 4-4C). Esto significa que la velocidad a la que se forma el metanol (medida en moles por unidad de volumen por unidad de tiempo) dependerá de la concentración de clorometano, pero no de la concentración de iones hidróxido, ya que el ion hidróxido no se utiliza excepto en una reacción secundaria rápida. En contraste, Mechanism\(B\) requiere que la velocidad dependa de las concentraciones de ambos reactivos porque el paso lento implica colisiones entre iones hidróxido y moléculas de clorometano.
\[ v = k_A [CH_3Cl] \label{8-1}\]
\[ v = k_B [CH_3Cl][OH^-] \label{8-2}\]
Más precisamente, la velocidad de reacción (\(\nu\)) puede expresarse en términos de Ecuación\(\ref{8-1}\) para Mecanismo\(A\) y Ecuación\(\ref{8-2}\) para Mecanismo\(B\):
Habitualmente,\(\nu\) se expresa en moles de producto formado por litro de solución por unidad de tiempo (más frecuentemente en segundos). Los términos de concentración\(\left[ CH_3Cl \right]\) y luego\(\left[ OH^\ominus \right]\) están en unidades de moles por litro, y la constante de proporcionalidad\(k\) (llamada constante de velocidad específica) tiene las unidades de\(\text{sec}^{-1}\) para Mecanismo\(A\) y\(\text{mol}^{-1} \times \text{L} \times \text{sec}^{-1}\) para Mecanismo\(B\).
Es importante reconocer la diferencia entre el orden de una reacción con respecto a un reactivo específico y el orden general de una reacción. El orden de una reacción con respecto a un reactante particular es la potencia a la que se debe elevar la concentración de ese reactivo para tener proporcionalidad directa entre la concentración y la velocidad de reacción. De acuerdo con\(\ref{8-2}\) la Ecuación la velocidad de reacción del ion clorometano-hidróxido es de primer orden con respecto al clorometano y de primer orden con respecto al ion hidróxido. En\(\ref{8-1}\) la Ecuación la tasa es de primer orden con respecto al clorometano y de orden cero con respecto al ion hidróxido porque\(\left[ OH^\ominus \right]^0 = 1\). El orden general de reacción es la suma de los órdenes de los respectivos reactivos. Así, Ecuaciones\(\ref{8-1}\) y\(\ref{8-2}\) expresan las tasas de reacciones generales de primer orden y segundo orden, respectivamente.
Podemos utilizar el orden general de reacción para distinguir entre los dos mecanismos posibles,\(A\) y\(B\). Experimentalmente, se encuentra que la tasa de formación de metanol es proporcional a las concentraciones tanto de clorometano como de ión hidróxido. Por lo tanto, la velocidad de reacción es de segundo orden global y se expresa correctamente mediante Ecuación\(\ref{8-2}\). Esto significa que el mecanismo de la reacción es el proceso de una sola etapa\(B\). Tales reacciones generalmente se clasifican como sustituciones nucleofílicas bimoleculares, a menudo designadas\(\text{S}_\text{N}2\),\(\text{S}\) para sustitución,\(\text{N}\) para nucleofílicas, y\(2\) para bimoleculares, debido a que hay dos moléculas reaccionantes en estado de transición. Para resumir: Para una\(\text{S}_\text{N}2\) reacción,
- tasa:
\[ v = k[RX][Y] \label{8-3}\]
- mecanismo:
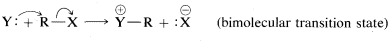
El Mecanismo paso a paso\(A\) es una sustitución nucleofílica unimolecular y en consecuencia se designa\(\text{S}_\text{N}1\). El numeral\(1\) (o\(2\)) utilizado en estas designaciones no se refiere al orden cinético de la reacción, sino al número de moléculas (sin incluir las moléculas de disolvente) que conforman el estado de transición. Así pues\(\text{S}_\text{N}1\),
- tasa:
\[ v = k[RX] \label{8-4}\]
- mecanismo:

o
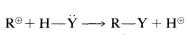
Solvolisis
Muchas\(\text{S}_\text{N}\) reacciones se llevan a cabo utilizando el disolvente como agente nucleofílico. Se llaman reacciones de solvolisis e involucran solventes como agua, etanol, ácido etanoico y ácido metanóico. Dos ejemplos son
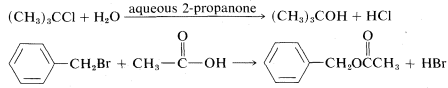
En estos ejemplos, la solvolisis es necesariamente una reacción de primer orden, porque normalmente el disolvente está en un exceso tan grande que su concentración no cambia apreciablemente durante la reacción, y de ahí su contribución a la velocidad no cambia. Sin embargo, que la velocidad global sea de primer orden no significa que la reacción necesariamente prosiga por un\(\text{S}_\text{N}1\) mecanismo, particularmente en disolventes como agua, alcoholes o aminas, que son agentes nucleofílicos razonablemente buenos. El disolvente puede actuar como agente de desplazamiento en una\(\text{S}_\text{N}2\) reacción.
Para distinguir entre\(\text{S}_\text{N}1\) y\(\text{S}_\text{N}2\) mecanismos de solvolisis se requieren otros criterios, notablemente la estereoquímica (Secciones 8-5 y 8-6), y el efecto de los nucleófilos añadidos sobre la velocidad y naturaleza de los productos de reacción. Por ejemplo, a menudo es posible distinguir entre\(\text{S}_\text{N}1\) y\(\text{S}_\text{N}2\) solvolisis añadiendo a la mezcla de reacción una concentración relativamente pequeña de una sustancia que se espera que sea un nucleófilo más potente que el disolvente. Si la reacción es estrictamente\(\text{S}_\text{N}1\), la velocidad a la que\(RX\) desaparece debe permanecer esencialmente sin cambios porque reacciona solo tan rápido como\(R^\oplus\) las formas, y la velocidad de este paso no se cambia por la adición del nucleófilo, incluso si el nucleófilo reacciona con\(R^\oplus\). Sin embargo, si la reacción es\(\text{S}_\text{N}2\), la velocidad de desaparición de\(RX\) debería aumentar porque\(RX\) reacciona con el nucleófilo en una\(\text{S}_\text{N}2\) reacción y ahora la velocidad depende tanto de la naturaleza como de la concentración del nucleófilo.
\(^4\)Muchos químicos orgánicos, y de hecho las versiones anteriores de este libro, utilizan el término “ion carbonio” para especies de este tipo. Sin embargo, existe un uso bien establecido del sufijo -onio, para amonio, oxonio, cloronio, etc., para denotar átomos cargados positivamente con conchas de valencia llenas. En aras de una mayor uniformidad de nomenclatura utilizaremos “carbocatión” para iones carbono positivos que tengan conchas de valencia sin llenar (6 electrones).
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


