8.9: La reacción de E2
- Page ID
- 73176
Cinética y Mecanismo
Las condiciones utilizadas para las reacciones de sustitución por el\(\text{S}_\text{N}2\) mecanismo muy a menudo conducen a la eliminación. La reacción de 2-bromopropano con etóxido de sodio en etanol proporciona un buen ejemplo:
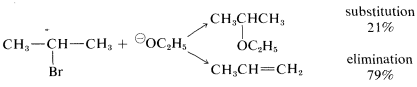
La eliminación para dar propeno compite con la sustitución para dar etil isopropil éter. Además, la tasa de eliminación, al igual que la tasa de sustitución, es proporcional a las concentraciones de 2-bromopropano y ion etóxido. Por lo tanto, la eliminación aquí es una reacción de segundo orden (puede ser útil revisar la Sección 8-4 en este punto):
tasa de sustitución\(= k_S \left[ R Br \right] \left[ \overset{\ominus}{O} C_2H_5 \right]\)
tasa de eliminación\(= k_E \left[ R Br \right] \left[ \overset{\ominus}{O} C_2H_5 \right]\)
En cuanto al mecanismo de este tipo de eliminación, la base atacante\(^\ominus OC_2H_5\),, elimina un protón del\(\beta\) carbono más o menos simultáneamente con la formación del doble enlace y la pérdida de ion bromuro del carbono vecino:
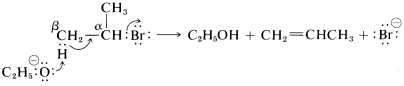
La abreviatura de este mecanismo es \(\text{E}2\),\(\text{E}\) para eliminación y\(2\) para bimolecular, habiendo dos reactivos involucrados en el estado de transición.
Efectos Estructurales
Las influencias estructurales sobre\(\text{E}2\) las reacciones han sido estudiadas con cierto detalle. Al igual que el\(\text{S}_\text{N}2\) proceso de competencia, es necesario un buen grupo saliente y de estos, los más utilizados son los haluros\(Cl\)\(Br\),, y\(I\); ésteres de sulfonato\(RS \left( O_2 \right) O-\); y iones -onio como amonio,\(\overset{\oplus}{N} R_4\), y sulfonio,\(\overset{\oplus}{S} R_3\):
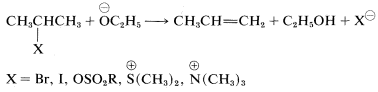
Generalmente se requieren bases bastante fuertes para llevar a cabo la\(\text{E}2\) reacción. La efectividad de una serie de bases generalmente es paralela a sus fuerzas básicas, y\(\overset{\ominus}{N} H_2\)\(>\)\(\overset{\ominus}{O} C_2H_5\)\(>\)\(\overset{\ominus}{O} H\)\(>\)\(\overset{\ominus}{O} CCH_3\) se observa el orden para\(\text{E}2\) las reacciones. Este hecho es importante en la planificación de síntesis prácticas, ya que la\(\text{E}2\) reacción tiende a predominar con reactivos fuertemente básicos y ligeramente polarizables como el ion amida\(\overset{\ominus}{N} H_2\), o el ion etóxido,\(\overset{\ominus}{O} C_2H_5\). Por el contrario,\(\text{S}_\text{N}2\) las reacciones tienden a ser favorecidas con nucleófilos débilmente básicos como el ion yoduro o el ion etanoato (a menos que se utilicen disolventes apróticos dipolares, que pueden cambiar notablemente la reactividad de los nucleófilos aniónicos).
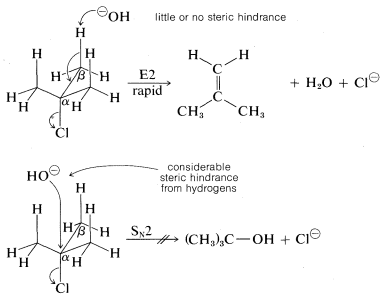
En cuanto al grupo alquilo, hay dos efectos estructurales importantes a notar. Primero, se requiere al menos un\(C-H\) enlace adyacente (\(\beta\)) al grupo saliente. Segundo, la facilidad de\(\text{E}2\) eliminación sigue el orden terciario\(R\)\(>\) secundario\(R\)\(>\) primario\(R\). A diferencia de\(\text{S}_\text{N}2\) las reacciones, que no se observan para los compuestos de alquilo terciario debido al impedimento estérico para el acercamiento del nucleófilo al carbono, la\(\text{E}2\) reacción relacionada suele ocurrir fácilmente con\(RX\) compuestos terciarios. La razón es que es probable que poco o ningún obstáculo estérico para el acercamiento de una base a un hidrógeno a menos que la base sea excepcionalmente voluminosa:
El orden de reactividad también parece correlacionarse con la energía del\(C-X\) enlace, ya que los haluros de alquilo terciario son ambos más reactivos y tienen enlaces carbono-halógeno más débiles que los haluros primarios o secundarios (ver Tabla 4-6). De hecho, la eliminación\(HX\) de haloalquenos o haloarenos con\(C-X\) enlaces relativamente fuertes, como cloroeteno o clorobenceno, es mucho menos fácil que para los haloalcanos. Sin embargo, la eliminación ocurre en las condiciones adecuadas y constituye uno de los métodos generales más útiles para la síntesis de alquinos. Por ejemplo,
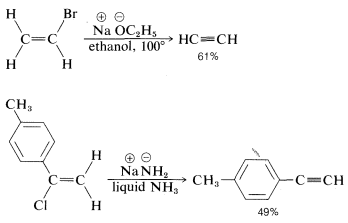
Las condiciones y reactivos utilizados para\(\text{E}2\) y\(\text{S}_\text{N}2\) reacciones son lo suficientemente similares como para que sea difícil que uno ocurra sin el otro. Sin embargo,\(\text{E}2\) la eliminación se ve favorecida sobre la\(\text{S}_\text{N}2\) sustitución por (a) nucleófilos fuertemente básicos, (b) nucleófilos voluminosos y (c) aumento de la sustitución de alquilo en el\(\alpha\) carbono. También se observa que el aumento de la temperatura de reacción generalmente conduce a un aumento en la eliminación a expensas de la sustitución. De hecho, se pueden obtener rendimientos sorprendentemente buenos de alqueno o alquino añadiendo un compuesto halógeno directamente a fundido o muy caliente\(KOH\) sin disolvente presente, después de lo cual el producto se forma rápidamente y se destila inmediatamente de la mezcla de reacción caliente:
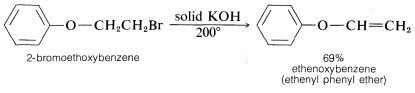
Efectos de orientación en las reacciones de eliminación
Con haluros que tienen\(R\) grupos asimétricos, como el 2-cloro-2-metilbutano, es posible formar dos o más alquenos diferentes, dependiendo la proporción de las velocidades relativas a las que se eliminan\(\beta\) los diferentes hidrógenos. La mayoría de\(\text{E}2\) las eliminaciones de haluros de alquilo con bases comunes\(HO^\ominus\)\(C_2H_5O^\ominus\), tales como\(NH_2^\ominus\),, y, tienden a dar mezclas de alquenos con preferencia por el alqueno más estable, que suele ser el que tiene menos hidrógenos o la mayoría de los grupos alquilo unidos al carbonos del doble enlace. Por lo tanto
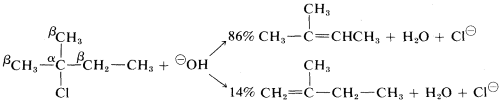
Sin embargo, se encuentra que la distribución precisa de los alquenos formados varía lo suficiente con la naturaleza del grupo saliente, o la base utilizada, por lo que cualquiera de los productos predominará con alguna combinación de reactivos o condiciones. Por ejemplo, un cambio en la base por sí solo puede ser decisivo:
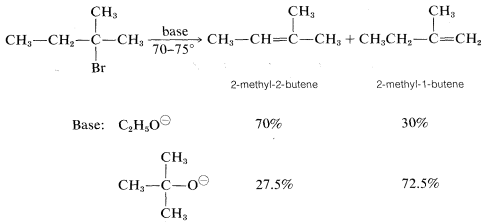
Estereoquímica de\(\text{E}2\) las reacciones
La\(\text{E}2\) reacción ocurre más fácilmente si la molécula sometida a reacción puede asumir una conformación,\(2\), en la que los grupos salientes,\(H\) y\(X\), son trans entre sí y los átomos se\(H-C_\beta-C_\alpha-X\) encuentran en un plano. La eliminación procede entonces de lados opuestos del doble enlace incipiente para dar un alqueno de estructura\(3\). Llamaremos a este modo de eliminación antarafacial para distinguir
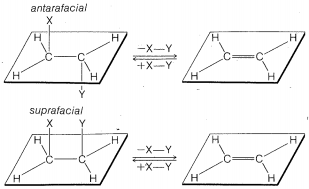
desde otro posible modo de eliminación que se llama suprafacial. (Ver Figura 8-6). \(^8\)
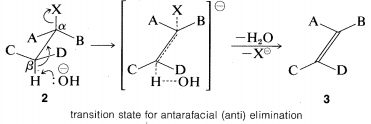
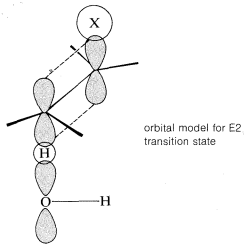
El estado de transición para la conversión de\(2\) a\(3\) es particularmente razonable porque combina parte de la geometría tanto de los reactivos como de los productos y, por lo tanto, da el mejor solapamiento de los orbitales de reacción necesarios para la formación del\(\pi\) enlace. Esto se muestra de manera más explícita a continuación. \(^9\)
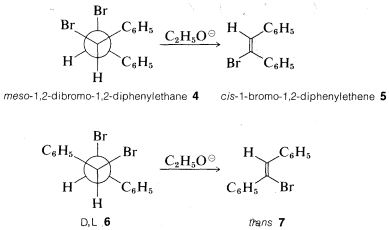
Como ilustración de la estereoespecificidad de las eliminaciones, el compuesto meso\(4\) da el cis-alqueno\(5\), mientras que los\(D,L\) isómeros\(6\) dan el trans-alqueno\(7\) con etóxido. Ambas reacciones proceden claramente por eliminación antarafacial:
Cuando la eliminación antarafacial se vuelve difícil por la incapacidad de los grupos reaccionantes para adquirir la disposición trans deseada, entonces la eliminación suprafacial puede ocurrir, aunque con menor facilidad. Un ejemplo es el clorociclopentano, en el que\(H\) y\(X\) no puede asumir una configuración trans sin una cepa muy considerable pero que sí sufre eliminación suprafacial a una velocidad razonable:
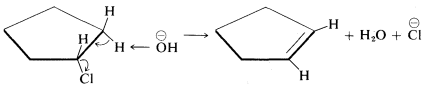
\(^9\)Se han hecho argumentos persuasivos de que muchas\(\text{E}2\) reacciones proceden por la secuencia
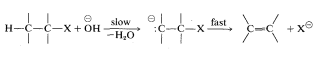
Si esto es así, todavía se prevé que se favorezca la eliminación antarafacial.
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


