10.2: Propiedades Físicas y Espectroscópicas de Alquenos y Alquinos
- Page ID
- 73432
Propiedades Físicas
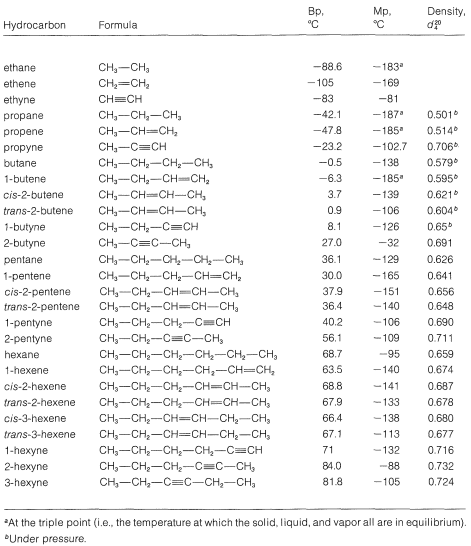
En general, las propiedades físicas de los alquenos son similares a las de los alcanos. Los datos del Cuadro 10-1 permiten comparar los puntos de ebullición, puntos de fusión y densidades de varios alquenos con los alcanos correspondientes que tienen el mismo esqueleto de carbono. Al igual que los alcanos de cadena continua, los 1-alquenos forman una serie homóloga de compuestos que muestran cambios regulares en las propiedades físicas al aumentar la longitud de la cadena. Los puntos de ebullición, puntos de fusión y densidades de los alquinos simples (también incluidos en la Tabla 10-1) son algo mayores que los de los alcanos o alquenos correspondientes, y estas propiedades también muestran cambios regulares a medida que aumenta la longitud de la cadena.
Cuadro 10-1: Comparación de las propiedades físicas de alcanos, alquenos y alquinos
Propiedades espectroscópicas de los alquenos
Los espectros infrarrojos de los alquenos son suficientemente diferentes de los alcanos en la mayoría de los casos para permitir reconocer cuando hay un doble enlace presente. Por ejemplo, en el espectro infrarrojo del 1-buteno (Figura 10-1) la banda de absorción cercana\(1650 \: \text{cm}^{-1}\) es característica de la vibración de estiramiento del doble enlace. En general, la intensidad y posición de esta banda depende de la estructura del alqueno; varía con el grado de ramificación en el doble enlace, con la presencia de un segundo grupo insaturado en conjugación con el primero (es decir,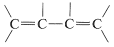 o
o ), y con la simetría de la sustitución del doble enlace (ver Sección 9-7B). Sin embargo, en muchos casos las bandas de absorción causadas por los diversos modos de vibración de los\(\ce{C-H}\) enlaces alquénicos frecuentemente son más útiles para detectar un doble enlace e identificar su tipo que la banda de absorción causada por el\(\ce{C=C}\) estiramiento. Con 1-buteno, las absorciones que surgen de las\(\ce{C-H}\) vibraciones del\(\ce{=CH_2}\) grupo terminal ocurren cerca\(3100 \: \text{cm}^{-1}\),\(1420 \: \text{cm}^{-1}\), y\(915 \: \text{cm}^{-1}\), y las del\(\ce{-CH=}\) agrupamiento cerca\(3020 \: \text{cm}^{-1}\),\(1420 \: \text{cm}^{-1}\), y\(1000 \: \text{cm}^{-1}\). En general, las bandas de absorción a estas frecuencias son de la agrupación\(\ce{-CH=CH_2}\). Las bandas cercanas\(1420 \: \text{cm}^{-1}\) se deben a la flexión en el plano, mientras que las\(915 \: \text{cm}^{-1}\) que\(1000 \: \text{cm}^{-1}\) surgen de la flexión fuera del plano. Las otras absorciones intensas, cercanas\(1460 \: \text{cm}^{-1}\) y\(3000 \: \text{cm}^{-1}\), se deben a\(\ce{C-H}\) vibraciones del\(\ce{CH_3CH_2}-\) grupo (ver Sección 9-7D). Estos ilustran otro punto, a saber, las posiciones de las absorciones infrarrojas de los\(\ce{C-H}\) enlaces alquilo son significativamente diferentes de las de los\(\ce{C-H}\) enlaces alquénicos.
), y con la simetría de la sustitución del doble enlace (ver Sección 9-7B). Sin embargo, en muchos casos las bandas de absorción causadas por los diversos modos de vibración de los\(\ce{C-H}\) enlaces alquénicos frecuentemente son más útiles para detectar un doble enlace e identificar su tipo que la banda de absorción causada por el\(\ce{C=C}\) estiramiento. Con 1-buteno, las absorciones que surgen de las\(\ce{C-H}\) vibraciones del\(\ce{=CH_2}\) grupo terminal ocurren cerca\(3100 \: \text{cm}^{-1}\),\(1420 \: \text{cm}^{-1}\), y\(915 \: \text{cm}^{-1}\), y las del\(\ce{-CH=}\) agrupamiento cerca\(3020 \: \text{cm}^{-1}\),\(1420 \: \text{cm}^{-1}\), y\(1000 \: \text{cm}^{-1}\). En general, las bandas de absorción a estas frecuencias son de la agrupación\(\ce{-CH=CH_2}\). Las bandas cercanas\(1420 \: \text{cm}^{-1}\) se deben a la flexión en el plano, mientras que las\(915 \: \text{cm}^{-1}\) que\(1000 \: \text{cm}^{-1}\) surgen de la flexión fuera del plano. Las otras absorciones intensas, cercanas\(1460 \: \text{cm}^{-1}\) y\(3000 \: \text{cm}^{-1}\), se deben a\(\ce{C-H}\) vibraciones del\(\ce{CH_3CH_2}-\) grupo (ver Sección 9-7D). Estos ilustran otro punto, a saber, las posiciones de las absorciones infrarrojas de los\(\ce{C-H}\) enlaces alquilo son significativamente diferentes de las de los\(\ce{C-H}\) enlaces alquénicos.

Los dobles enlaces de un alqueno sin hidrógenos alquénicos son difíciles de detectar por espectroscopía infrarroja y en tales casos es útil la espectroscopia Raman (ver Sección 9-8).
La absorción infrarroja de 1-buteno que ocurre en\(1830 \: \text{cm}^{-1}\) (Figura 10-1) cae en la región donde generalmente no se observan vibraciones de estiramiento de los enlaces alquenos. Sin embargo, esta banda en realidad surge de un armónico (armónico) de la flexión\(\ce{=CH_2}\) fuera del plano en\(915 \: \text{cm}^{-1}\). Tales absorciones de armónicos llegan exactamente al doble de la frecuencia de la frecuencia fundamental, y siempre que se observe una absorción como esta que no parece encajar con las vibraciones fundamentales normales, se debe verificar la posibilidad de que sea un armónico.
Con respecto a los espectros electrónicos, un\(\pi\) electrón de un alqueno simple puede excitarse a un\(\left( \pi^* \right)\) estado de mayor energía por luz de longitud de onda\(180 \: \text{nm}\) a\(100 \: \text{nm}\). Sin embargo, muchas otras sustancias absorben en esta región del espectro, incluyendo el aire, la celda de muestra de cuarzo y la mayoría de los solventes que podrían usarse para disolver la muestra, y como resultado los espectros de alquenos simples no se obtienen fácilmente con los espectrómetros ultravioleta habituales. Cuando el doble enlace se conjuga como en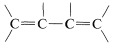 o
o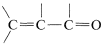 , entonces las longitudes de onda de absorción máxima se desplazan a longitudes de onda más largas y tales absorciones se determinan de manera más fácil y precisa (ver también la Sección 9-9B).
, entonces las longitudes de onda de absorción máxima se desplazan a longitudes de onda más largas y tales absorciones se determinan de manera más fácil y precisa (ver también la Sección 9-9B).
En los espectros de RMN protónica, los desplazamientos químicos de los hidrógenos alquénicos son hacia campos más bajos que los de los hidrógenos alcanos y normalmente caen en el rango de\(4.6\) -\(5.3 \: \text{ppm}\) relativo a TMS (ver sección 9-10E y Cuadro 9-4). Los acoplamientos espín-espín de hidrógenos alquénicos se discuten en las secciones 9-10G y 9-10J.
Propiedades espectroscópicas de los alquinos
El espectro infrarrojo de un alquino monosustituido como el etinilbenceno,\(\ce{C_6H_5C \equiv CH}\) (Figura 10-4), tiene una banda fuerte cerca\(3300 \: \text{cm}^{-1}\), lo cual es característico de la vibración de estiramiento carbono-hidrógeno en el agrupamiento\(\ce{\equiv C-H}\). A una frecuencia más baja (longitud de onda más larga) alrededor\(2100 \: \text{cm}^{-1}\), hay una banda asociada con la vibración de estiramiento del triple enlace (ver también la Figura 9-36). Por lo tanto, la presencia del agrupamiento\(\ce{-C \equiv CH}\) en una molécula puede detectarse fácilmente mediante espectroscopía infrarroja. Sin embargo, el triple enlace de un alquino disustituido\(\ce{R-C \equiv C-R}\),, se detecta con menor facilidad porque no hay\(\ce{\equiv C-H}\) absorción cerca\(3300 \: \text{cm}^{-1}\), y además la\(\ce{C \equiv C}\) absorción a veces es de tan baja intensidad que puede ser indiscernible. La espectroscopia Raman (Sección 9-8) o métodos químicos deben ser utilizados para confirmar la presencia de un triple enlace.
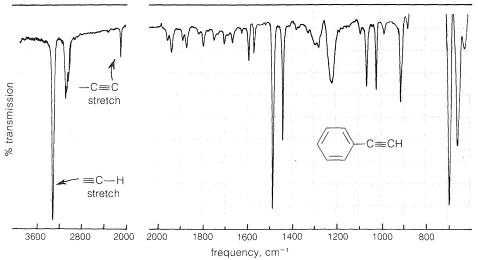
Los alquinos, al igual que los alquenos, experimentan fuerte absorción electrónica solo a longitudes de onda en la región relativamente inaccesible inferior\(200 \: \text{nm}\). Sin embargo, cuando se conjuga un triple enlace con uno o más grupos insaturados, se absorbe la radiación de longitud de onda más larga. Para ilustrar, el etino absorbe en\(150 \: \text{nm}\) y\(173 \: \text{nm}\), mientras que el 1-buten-3-ino\(\left( \ce{CH_2=CH-C \equiv CH} \right)\) absorbe en\(219 \: \text{nm}\) y\(227.5 \: \text{nm}\). Los efectos de dicha conjugación sobre los espectros se discuten con más detalle en la Sección 9-9B.
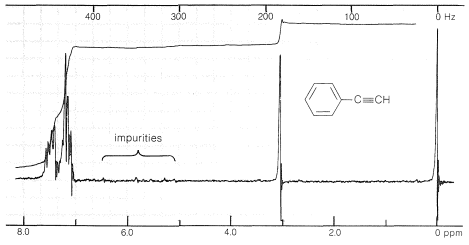
El espectro de resonancia magnética nuclear protónica del etinilbenceno se muestra en la Figura 10-5. Los picos se\(185 \: \text{Hz}\) acercan\(435 \: \text{Hz}\) y corresponden a resonancias del fenilo y\(\ce{\equiv C-H}\) protones, respectivamente. La diferencia en el desplazamiento químico entre los dos tipos de protones es considerablemente mayor que entre los protones alquénicos y aromáticos que entran en resonancia a campos magnéticos superiores (es decir, están sujetos a más blindaje diamagnético, Sección 9-10E) que los protones alquénicos o aromáticos. De hecho, los\(\ce{\equiv C-H}\) protones de los alquinos tienen desplazamientos químicos que se acercan a los de los protones alquílicos. (Ver también la Figura 9-36.)
Los espectros de masas de alquenos y alquinos suelen dar distintos iones moleculares; sin embargo, la fragmentación suele ser compleja y no se interpreta fácilmente.
Referencias
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


