10.9: Polimerización de Alquenos
- Page ID
- 73452
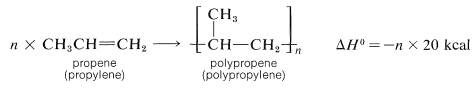
Una de las reacciones técnicas más importantes de los alquenos es su conversión a compuestos o polímeros de mayor peso molecular (Cuadro 10-4). Un polímero se define como una molécula de cadena larga con unidades estructurales recurrentes. Así, la polimerización del propeno da un hidrocarburo de cadena larga con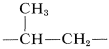 unidades recurrentes:
unidades recurrentes:
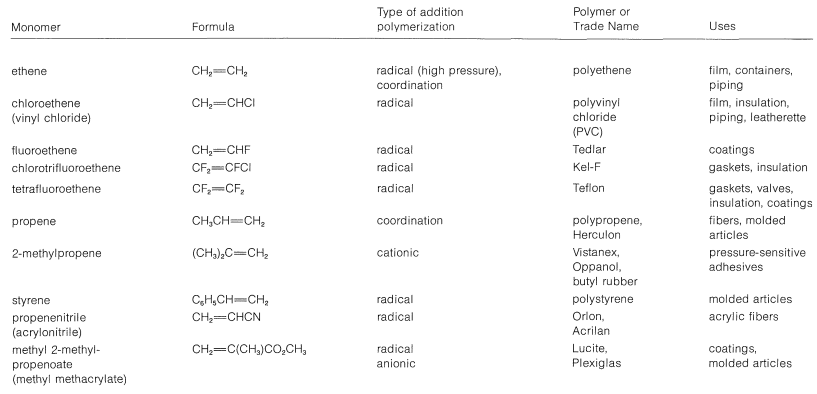
Cuadro 10-4: Monómeros de alqueno y sus polímeros
La mayoría de las polimerizaciones técnicamente importantes de alquenos ocurren por mecanismos de cadena y pueden clasificarse como reacciones aniónicas, catiónicas o radicales, dependiendo del carácter de las especies portadoras de cadena. En cada caso, los pasos clave implican adiciones sucesivas a moléculas del alqueno, estando las diferencias en el número de electrones que son suministrados por el agente atacante para la formación del nuevo enlace carbono-carbono. Por simplicidad, estos pasos se ilustrarán mediante el uso de eteno, aunque no se polimeriza muy fácilmente por ninguno de ellos:
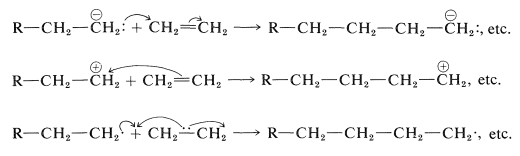
Polimerización aniónico
La iniciación de la polimerización de alquenos por el mecanismo de cadena aniónica puede formularse como que implica un ataque por un reactivo nucleófilo\(\ce{Y}^\ominus\) en un extremo del doble enlace y la formación de un carbanión:
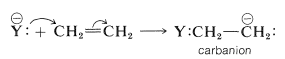
El ataque del carbanión sobre otra molécula de alqueno daría un carbanión de cuatro carbonos, y las adiciones posteriores a moléculas de alqueno adicionales conducirían a un anión de alto peso molecular:
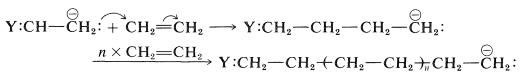
La cadena en crecimiento puede terminarse por cualquier reacción (como la adición de un protón) que destruya el carbanión en el extremo de la cadena:
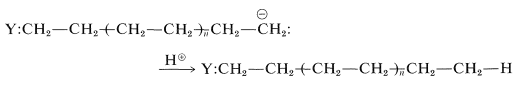
La polimerización aniónica de alquenos es bastante difícil de lograr porque pocos aniones (o nucleófilos) son capaces de agregar fácilmente a los dobles enlaces alquenos (ver Sección 10-6). La polimerización aniónica ocurre fácilmente solo con alquenos sustituidos con grupos atrayentes de electrones suficientemente potentes para acelerar el ataque nucleofílico. Por este razonamiento, los alquinos deberían polimerizarse más fácilmente que los alquenos bajo condiciones aniónicas, pero no parece haber polimerizaciones de alquinos técnicamente importantes en funcionamiento por este o cualquier otro mecanismo. Quizás esto se deba a que el polímero resultante sería altamente conjugado, y por lo tanto altamente reactivo, y podría no sobrevivir a las condiciones experimentales:
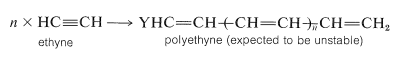
Polimerización catiónico
La polimerización de un alqueno mediante reactivos ácidos puede formularse mediante un mecanismo similar a la adición de haluros de hidrógeno a enlaces alquenos. Primero, un protón de un ácido adecuado se agrega a un alqueno para producir un carbocatión. Entonces, en ausencia de cualquier otro reactivo nucleófilo razonablemente fuerte, otra molécula de alqueno dona un par de electrones y forma un catión de cadena más larga. La continuación de este proceso puede conducir a un catión de alto peso molecular. La terminación puede ocurrir por pérdida de un protón. Las siguientes ecuaciones representan la secuencia de reacción global:
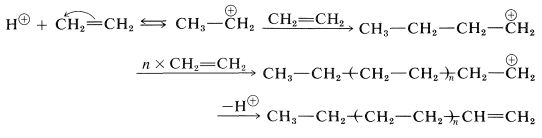
El eteno no polimeriza por el mecanismo catiónico porque no tiene grupos suficientemente donadores de electrones para permitir la fácil formación del catión de cadena de crecimiento intermedio. El 2-metilpropeno tiene grupos alquilo donadores de electrones y polimeriza mucho más fácilmente que el eteno por este tipo de mecanismo. Los catalizadores habituales para la polimerización catiónica de 2-metilpropeno son ácido sulfúrico, fluoruro de hidrógeno o un complejo de trifluoruro de boro y agua. Bajo condiciones casi anhidras se forma un polímero de cadena muy larga llamado poliisobutileno.
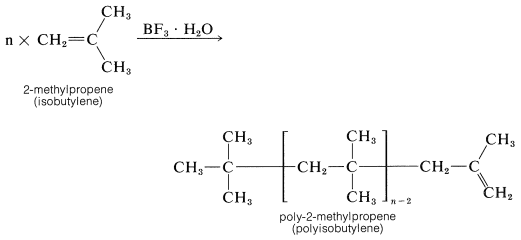
Las fracciones de poliisobutileno de pesos moleculares particulares son muy pegajosas y se utilizan como adhesivos para cintas de sellado a presión.
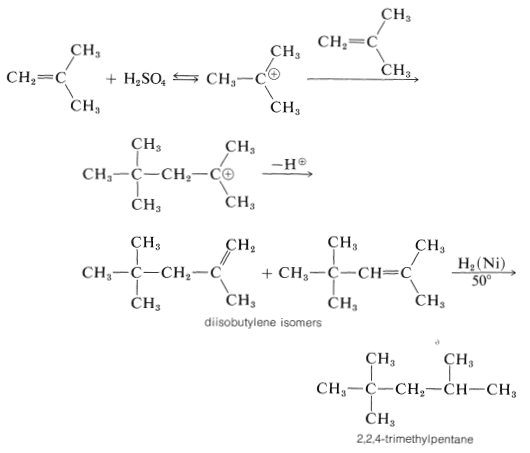
En presencia de ácido\(60\%\) sulfúrico, el 2-metilpropeno no se convierte en un polímero de cadena larga, sino en una mezcla de alquenos de ocho carbonos. El mecanismo es como el de la polimerización del 2-metilpropeno en condiciones casi anhidras, excepto que la terminación de la cadena ocurre después de que solo se ha agregado una molécula de 2-metilpropeno:
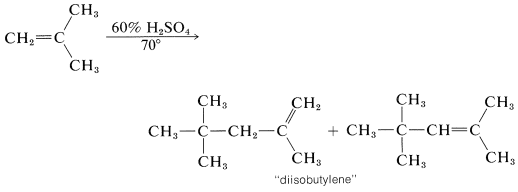
La longitud de cadena corta se debe a la alta concentración de agua; el carbocatión intermedio pierde un protón por el agua antes de que pueda reaccionar con otra molécula de alqueno.
El protón se puede perder de dos maneras diferentes, y se obtiene una mezcla de isómeros alquenos. La mezcla de alquenos se conoce como “diisobutileno” y tiene una serie de usos comerciales. La hidrogenación produce 2,2,4-trimetilpentano (a menudo erróneamente llamado “isooctano”), que se utiliza como el combustible estándar “100 antiknock rating” para motores de gasolina de combustión interna:
Polimerización radical
El eteno se puede polimerizar con catalizadores de peróxido a alta presión (\(1000 \: \text{atm}\)o más, literalmente en un cañón de cañón) a temperaturas superiores a\(100^\text{o}\). La etapa de iniciación implica la formación de radicales, y la propagación de la cadena implica la adición escalonada de radicales a las moléculas de eteno.
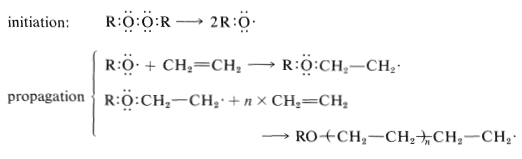
La terminación de la cadena puede ocurrir por cualquier reacción que resulte en combinación o desproporción de radicales libres.
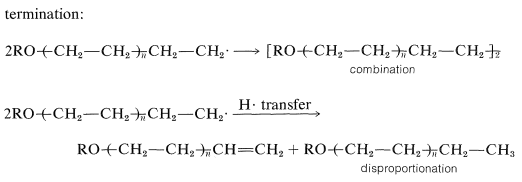
El polietileno producido de esta manera tiene de 100 a 1000 unidades de eteno en la cadena hidrocarbonada. El polímero posee una serie de propiedades deseables como plástico y se usa ampliamente para aislamiento eléctrico, películas de envasado, tuberías y una variedad de artículos moldeados. El propeno y el 2-metilpropeno no polimerizan satisfactoriamente por mecanismos radicales.
Coordinación Polimerización
Se ha logrado una polimerización de eteno a baja presión y temperatura relativamente baja con un catalizador de óxido de aluminio-molibdeno, que requiere activación ocasional con hidrógeno (proceso Phillips Petroleum). El eteno también polimeriza bastante rápidamente a presión atmosférica y temperatura ambiente en un disolvente alcano que contiene una suspensión del producto de reacción insoluble a partir de trietilaluminio y tetracloruro de titanio (proceso Ziegler). Tanto los procesos Phillips como Ziegler producen polietileno de muy alto peso molecular con propiedades físicas excepcionales. Las características inusuales de estas reacciones indican que no se puede involucrar ningún mecanismo simple de aniones, cationes o radicales. Se cree que los catalizadores actúan coordinándose con las moléculas de alqueno de la misma manera que los catalizadores de hidrogenación se combinan con los alquenos (Sección 11-2A).
La polimerización de propeno por el proceso Ziegler da un material plástico muy útil. Se puede convertir en fibras duraderas o moldearse en una variedad de formas. Los copolímeros (polímeros con más de un tipo de unidad de monómero en las cadenas poliméricas) de eteno y propeno fabricados por el proceso Ziegler tienen propiedades similares al caucho altamente deseables y son potencialmente los elastómeros útiles más baratos (polímeros elásticos). Un Premio Nobel fue compartido en 1963 por K. Ziegler y G. Natta por su trabajo sobre la polimerización de alquenos.
Las propiedades y usos de los polímeros se discuten con mayor detalle en los Capítulos 13 y 29. Los monómeros alquenos más importantes utilizados en las polimerizaciones adicionales se enumeran en la Tabla 10-4 junto con algunos nombres y usos de los polímeros correspondientes.
Referencias
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


