12.3: Conformaciones de Cicloalcanos
- Page ID
- 73123
Los equilibrios (estabilidades relativas) y el equilibrio (tasa de interconversión) de las conformaciones rotacionales de etano y butano se discutieron en la Sección 5-2. Si revisas este material, quedará claro que formar un anillo a partir de una cadena hidrocarbonada reducirá en gran medida el número de posibles conformaciones escalonadas y eclipsadas. Comenzaremos nuestra discusión con ciclohexano por su especial importancia, procederemos a anillos más pequeños, luego daremos una breve exposición de las conformaciones de los anillos más grandes.
Conformaciones de ciclohexano
Si los carbonos de un anillo de ciclohexano se colocaran en las esquinas de un hexágono plano regular, todos los ángulos de\(\ce{C-C-C}\) unión tendrían que ser\(120^\text{o}\). Debido a que el ángulo de\(\ce{C-C-C}\) enlace normal esperado debe estar cerca del valor tetraédrico de\(109.5^\text{o}\), la configuración plana sugerida del ciclohexano tendría deformación angular en cada uno de los carbonos, y correspondería a moléculas de ciclohexano menos estables que aquellas con ángulos de enlace más normales. El valor normal real para el ángulo de\(\ce{C-C-C}\) unión de una\(\ce{-CH_2-CH_2-CH_2}-\) unidad de cadena abierta parece ser aproximadamente\(112.5^\text{o}\), el cual es\(3^\text{o}\) mayor que el valor tetraédrico. De esto podemos concluir que la deformación angular en cada carbono de un ciclohexano plano sería\(\left( 120^\text{o} - 112.5^\text{o} \right) = 7.5^\text{o}\). La deformación angular no es toda la historia con respecto a la inestabilidad de la forma plana, ya que además de tener ángulos de\(\ce{C-C-C}\) unión diferentes a sus valores normales, la estructura plana también tiene sus carbonos e hidrógenos en la disposición eclipsada desfavorable, como se muestra en la Figura 12-2.
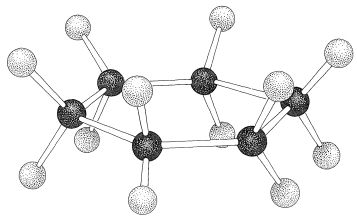
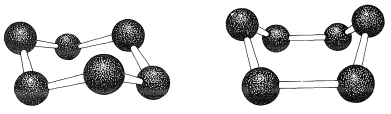
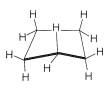
Si los ángulos de valencia de carbono se mantienen cerca del valor tetraédrico, encontrará que puede construir modelos de bola y varilla del anillo de seis carbonos de ciclohexano con dos conformaciones bastante diferentes. Estas son conocidas como las conformaciones de “silla” y “barco” (Figura 12-3). No ha sido posible separar el ciclohexano a temperatura ambiente en formas isoméricas puras que corresponden a estas conformaciones, y en realidad las dos formas parecen estar rápidamente interconvertidas. La conformación de la silla es considerablemente más estable y comprende más\(99.9\%\) de la mezcla de equilibrio a temperatura ambiente. \(^1\)
¿Por qué la forma de jabalí es menos estable que la forma de silla, si ambas tienen ángulos de\(\ce{C-C-C}\) unión normales? La respuesta es que la forma de barco tiene interacciones desfavorables no enlazadas entre los átomos de hidrógeno alrededor del anillo. Si hacemos normales todos los ángulos de unión y orientamos los carbonos para dar la conformación de “barco extremo” de la Figura 12-4, un par de 1,4 hidrógenos (los llamados hidrógenos “asta de bandera”) tienen que estar muy unidos entre sí\(\left( 1.83 \: \text{Å} \right)\). Los hidrógenos tan cercanos estarían en la parte ascendente de una curva de energía potencial de repulsión, como la Figura 4-6, para interacciones no enlazadas hidrógeno-hidrógeno. Este obstáculo estérico a una\(\ce{H-H}\) distancia de\(1.83 \: \text{Å}\) corresponde a una energía de repulsión de aproximadamente\(3 \: \text{kcal mol}^{-1}\). Todavía hay otro factor que hace que la embarcación extrema sea desfavorable; a saber, que los ocho hidrógenos a lo largo de los “costados” de la embarcación están eclipsados, lo que los acerca sustancialmente más de lo que estarían en un arreglo escalonado (aproximadamente\(2.27 \: \text{Å}\) comparado con\(2.50 \: \text{Å}\)). Esto está en llamativo contraste con la forma de la silla (Figura 12-5), para la cual los hidrógenos adyacentes están en posiciones escalonadas entre sí alrededor del anillo. Por lo tanto, se espera que la forma de silla sea más estable que la forma de barco porque tiene menos repulsión entre los hidrógenos.
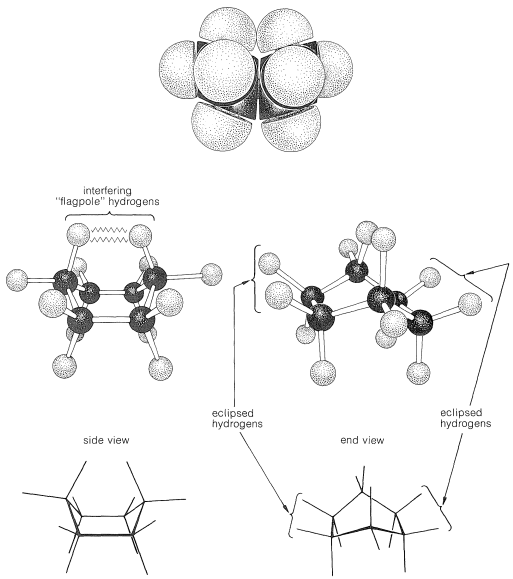
Debe hacer e inspeccionar modelos como los de la Figura 12-3 para ver la diferencia bastante llamativa entre las conformaciones de silla y barco que no es obvia a partir de los diagramas. Encontrarás que la estructura de la silla es bastante rígida, y la rotación no ocurre alrededor de los\(\ce{C-C}\) enlaces con interconversión a la estructura de la embarcación. En contraste, la forma del barco es bastante flexible. La rotación alrededor de\(\ce{C-C}\) los enlaces permite que el anillo se tuerza de una manera u otra desde la conformación extrema de la embarcación hasta conformaciones considerablemente más estables, de igual energía, en las que los hidrógenos del asta de la bandera se separan más y los ocho hidrógenos a lo largo de los lados se escalonan en gran medida pero no completamente. Estos arreglos se denominan conformaciones de barco giratorio (a veces skew-boat) (ver Figura 12-6) y se cree que son aproximadamente\(5 \: \text{kcal mol}^{-1}\) menos estables que la forma de la silla.
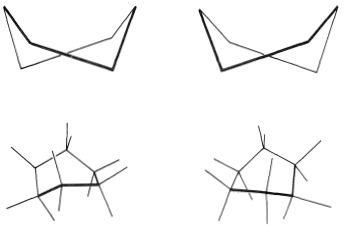
Es posible medir las propiedades espectrales de la forma de torcedura mediante una técnica muy elegante empleada por F. A. L. Anet. Debido a que la constante de equilibrio para la conversión de silla en barco aumenta con la temperatura, una proporción considerable de las moléculas existen como la forma de la barca de torsión en el vapor en\(800^\text{o}\). Si se permite que dicho vapor incida sobre una superficie enfriada\(20 \: \text{K}\), el condensado de película contiene aproximadamente la forma\(25\%\) de bote de torsión. A esta baja temperatura, la forma de bote de torsión se convierte en la forma de silla más estable a un ritmo muy lento. Se pueden tomar espectros infrarrojos de la mezcla de barco-silla en\(10 \: \text{K}\). Si se deja calentar la mezcla\(75 \: \text{K}\), se establece en poco tiempo el equilibrio normal que favorece la forma de la silla.
Modelos de Dreiding
La disposición espacial (estereoquímica) del ciclohexano y otros compuestos orgánicos se estudia convenientemente con la ayuda de modelos Dreiding, los cuales se realizan con ángulos de enlace estándar y distancias de enlace escaladas. Los enlaces tienen varillas de acero inoxidable que hacen un ajuste a presión en las mangas de acero inoxidable. La rotación es suave alrededor de las uniones y hay suficiente flexibilidad para adaptarse a cierta tensión angular. Los modelos de dragado de las conformaciones de ciclohexano se muestran en la Figura 12-7. Observe que estos modelos corresponden estrechamente a las representaciones de caballete en las Figuras 12-4, 12-5 y 12-6.

Equilibrios conformacionales y equilibración para derivados de ciclohexano
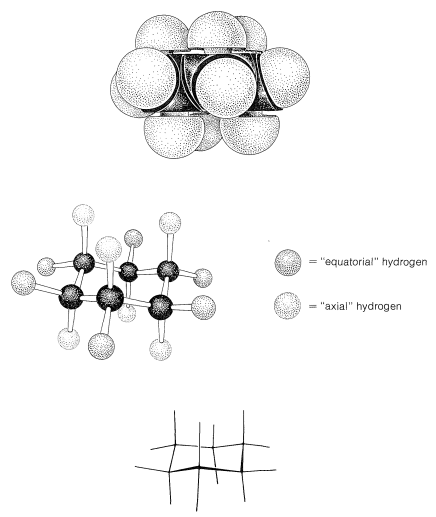
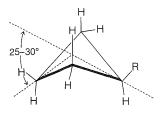
La Figura 12-5 muestra que hay dos tipos distintos de hidrógeno en forma de silla de ciclohexano: seis que están cerca del plano “promedio” del anillo (llamados hidrógenos ecuatoriales) y tres por encima y tres por debajo de este plano promedio (llamados hidrógenos axiales). Esto plantea preguntas interesantes en relación con los ciclohexanos sustituidos: Por ejemplo, ¿el grupo metilo en el metilciclohexano es ecuatorial o axial? Dado que solo se conoce un metilciclohexano, el grupo metilo debe ser exclusivamente ecuatorial\(\left( e \right)\), exclusivamente axial\(\left( a \right)\), o las dos formas deben ser interconvertidas tan rápidamente que no pueden separarse en formas isoméricas. Parece que prevalece esta última circunstancia, con el anillo cambiando rápidamente de una forma de silla a otra volteando un extremo de la silla hacia arriba y el otro extremo hacia abajo:
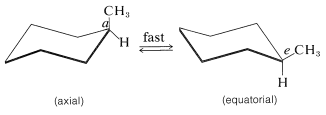
Tal cambio provocaría que un sustituyente en posición axial vaya a una posición ecuatorial y viceversa. Este proceso se llama inversión de anillo y su tasa a menudo se llama la frecuencia de inversión. Con el ciclohexano, la inversión es tan rápida a temperatura ambiente que, en promedio, las moléculas, voltean alrededor de 100,000 veces por segundo, sobre una barrera energética de aproximadamente\(11 \: \text{kcal mol}^{-1}\).
Comprenderás este proceso de volteo si haces un modelo de un anillo de ciclohexano que lleva un solo sustituyente. Al manipular el modelo se pueden descubrir algunas de las diferentes formas en que puede ocurrir el proceso. La ruta más sencilla es simplemente voltear una esquina del anillo para convertir la silla en un bote y luego voltear hacia abajo el carbono opuesto:
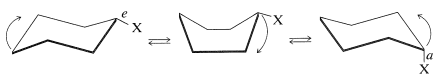
Debido a la flexibilidad de la conformación de la embarcación, es posible transformarla a otras conformaciones de embarcaciones mediante las cuales los carbonos distintos del indicado se voltean hacia abajo y completan la interconversión.
A temperatura ambiente la conformación del metilciclohexano con el metil ecuatorial es más estable que la que tiene el metil axial by\(1.7 \: \text{kcal mol}^{-1}\). Lo mismo ocurre con todos los ciclohexanos monosustituidos en mayor o menor grado. Las razones de esto se pueden observar a partir de modelos de relleno de espacio (Figura 12-8), que muestran que un grupo sustituyente tiene más espacio cuando el sustituyente es ecuatorial que cuando es axial. En la posición axial el sustituyente está considerablemente más cerca de los dos hidrógenos axiales en el mismo lado del anillo que a otros hidrógenos, incluso hidrógenos en carbonos adyacentes cuando el sustituyente está en la posición ecuatorial (Figura 12-8). Por ejemplo, cuando el sustituyente es bromo, que tiene una longitud de\(\ce{C-Br}\) enlace de\(1.94 \: \text{Å}\), la distancia desde el bromo axial al hidrógeno axial en\(\ce{C_3}\) o\(\ce{C_5}\) en el mismo lado del anillo es aproximadamente\(2.7 \: \text{Å}\). En contraste, la distancia desde el bromo ecuatorial a cualquiera de los hidrógenos en los carbonos adyacentes es aproximadamente\(3.1 \: \text{Å}\).
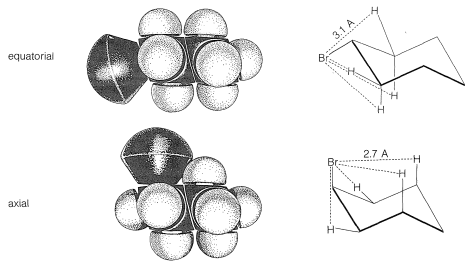
Hay un aspecto general muy importante de la diferencia entre estas dos\(\ce{H} \cdot \cdot \cdot \ce{Br}\) interacciones no unidas en\(2.7 \: \text{Å}\) y\(3.1 \: \text{Å}\). Siempre que dos átomos no unidos se acercan entre sí, y antes de que la repulsión masiva se establezca (lo que es tan evidente en la Figura 4-6), hay una ligera caída en la curva de energía correspondiente a la atracción. \(^2\)Para\(\ce{H} \cdot \cdot \cdot \ce{Br}\) las interacciones no enlazadas, el fondo de la inmersión se produce aproximadamente\(3.1 \: \text{Å}\) (Figura 12-9), y la atracción resultante entre los átomos proporcionará cierta estabilización de la conformación ecuatorial en relación con la conformación axial.
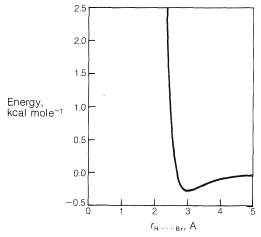
Las fuerzas de atracción débiles entre los átomos no unidos se denominan fuerzas atractivas de van der Waals,\(^3\) fuerzas de Londres o fuerzas de dispersión, y son de gran importancia para determinar las propiedades de los líquidos. También se puede esperar que desempeñen un papel en la determinación de los equilibrios de conformación siempre que las distancias entre los átomos en las conformaciones correspondan a los llamados mínimos de van der Walls.
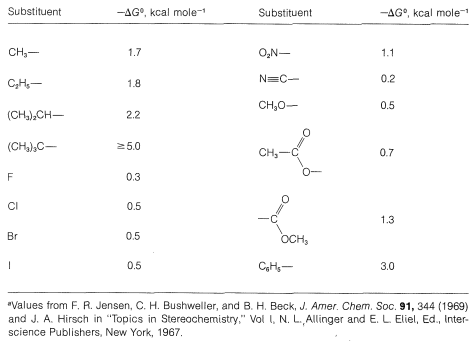
El Cuadro 12-2 muestra la contribución de diversos sustituyentes al cambio de energía libre de las orientaciones axial a ecuatorial del sustituyente. Así, para el bromo, el cambio de energía libre,\(\Delta G^0\), es\(-0.5 \: \text{kcal mol}^{-1}\), lo que significa que at\(25^\text{o}\), la constante de equilibrio,\(K\), para el equilibrio\(\rightleftharpoons\) ecuatorial axial es de aproximadamente 2.3 (de\(-2.303 RT \: \text{log} \: K = \Delta G^0\); ver Sección 4-4A).
De muchos estudios se sabe que la interconversión de conformaciones con el sustituyente en las posiciones ecuatorial y axial ocurre aproximadamente 100,000 veces por segundo, lo que corresponde a una energía de estado de transición (energía de activación) aproximadamente por\(11 \: \text{kcal mol}^{-1}\) encima de la energía del estado fundamental. La tasa disminuye a medida que se baja la temperatura. Si se enfría el clorociclohexano hasta su punto de fusión\(\left( -44^\text{o} \right)\), la sustancia cristaliza para dar el isómero ecuatorial puro. Luego, los cristales pueden enfriarse\(-150^\text{o}\) y disolverse a esta temperatura en un disolvente adecuado. En\(-150^\text{o}\) tardarían alrededor de 130 días para que la mitad de la forma ecuatorial se convirtiera a la forma axial. Sin embargo, cuando la solución se calienta a\(-60^\text{o}\) la conformación ecuatorial se convierte en la mezcla de equilibrio en unas décimas de segundo.
Cuadro 12-2: Selección\(\Delta G^0\) para el cambio de orientación axial a ecuatorial de sustituyentes para ciclohexanos monosustituidos
Iomerismo cis-Trans y Equilibrios Conformacionales para Derivados de Ciclohexano
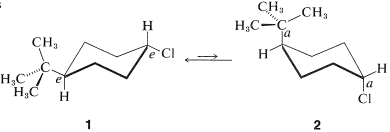
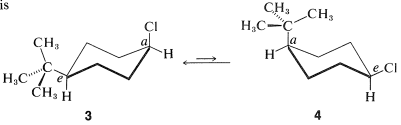
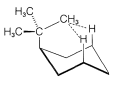
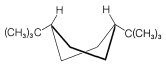
El isomerismo cis-trans de los derivados de ciclohexano (Sección 5-1A) se complica por el isomerismo conformacional. Por ejemplo, El cloruro de 4- terc - butilciclohexilo teóricamente podría existir en cuatro formas de silla estereoisoméricas\(1\),,\(2\),\(3\), y\(4\).
trans
cis
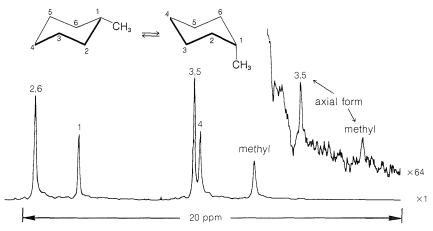
El uso de espectroscopía de\(\ce{^{13}C}\) RMN para determinar si un sustituyente está en una posición axial o ecuatorial se ilustra bien con cis - y trans-4-terc - butilciclohexanoles,\(5\) y\(6\):
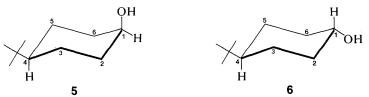
Ciclopentano
Los cinco\(\ce{-CH_2}-\) grupos de ciclopentano teóricamente podrían formar un pentágono plano regular (ángulos internos de\(108^\text{o}\)) con solo un poco de flexión de los ángulos de\(\ce{C-C-C}\) unión normales. En realidad, las moléculas de ciclopentano no son planas. La estructura plana ha eclipsado completamente los hidrógenos, lo que la hace menos estable aproximadamente\(10 \: \text{kcal mol}^{-1}\) que si no hubiera hidrógenos eclipsados. El resultado es que cada molécula asume una conformación arrugada que es el mejor compromiso entre la distorsión de los ángulos de enlace y la eclipsación de hidrógenos. Las mejores conformaciones de compromiso tienen el anillo retorcido con uno o dos de los\(\ce{-CH_2}-\) grupos doblados sustancialmente fuera de un plano que pasa a través de los otros carbonos (Figura 12-14). La flexibilidad del anillo es tal que estas deformaciones se mueven rápidamente alrededor del anillo.
Ciclobutano
La formación de un anillo de cuatro miembros de átomos de carbono solo se puede lograr con una distorsión sustancial de los ángulos de valencia normales del carbono, independientemente de si el anillo es plano o no planar. En el ciclobutano, por ejemplo, si se supone que los enlaces de valencia se encuentran a lo largo de líneas rectas dibujadas entre los núcleos de carbono, cada ángulo de\(\ce{C-C-C}\) enlace será\(19.5^\text{o}\) menor que el valor\(109.5^\text{o}\) tetraédrico:

Ciclopropano
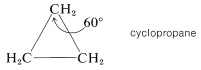
Los tres átomos de carbono del anillo de ciclopropano se encuentran en un plano. Por lo tanto, se espera que la deformación angular sea considerable debido a que cada ángulo de\(\ce{C-C-C}\) valencia debe deformarse\(49.5^\text{o}\) a partir del valor tetraédrico. Es probable que algún alivio de la tensión asociada con la eclipsación de los hidrógenos del ciclopropano se logre por la distorsión de los ángulos\(\ce{H-C-H}\) y de\(\ce{H-C-C}\) enlace:
“Cicloetano” (Eteno)
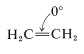
Si uno está dispuesto a considerar un doble enlace carbono-carbono como un anillo de dos miembros, entonces el eteno,\(\ce{C_2H_4}\), es el cicloalcano (“cicloetano”) más simple posible. Como tal,\(\ce{C_2H_4}\) tiene ángulos de\(\ce{C-C-C}\) valencia\(0^\text{o}\) y por lo tanto una deformación angular de\(109.5^\text{o}\) en cada\(\ce{CH_2}\) grupo en comparación con el valor tetraédrico:
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."
\(^1\)El trabajo pionero en las conformaciones del ciclohexano y sus derivados fue realizado por O. Hassel (Noruega) y D. H. R. Barton (Reino Unido) por lo que compartieron un Premio Nobel en 1969.
\(^2\)La escala vertical de la Figura 4-6 no permite ver la caída en la curva resultante de las fuerzas de atracción entre los átomos de neón. Es más profundo cuando\(r\) se trata\(3.12 \: Å\) y equivale a\(0.070 \: \text{kcal mol}^{-1}\).
\(^3\)Después de F. London, quien desarrolló una teoría cuántico-mecánica del origen de estas fuerzas y también fue pionero en muchos cálculos cuánticos de gran consecuencia para la química, incluyendo la unión en\(\ce{H_2}\), que se discutirá en la Sección 21-1.


