12.4: Cepa en anillos de cicloalcano
- Page ID
- 73108
La teoría de Baeyer
Muchas de las propiedades del ciclopropano y sus derivados son similares a las propiedades de los alquenos. En 1890, el famoso químico orgánico alemán, A. Baeyer, sugirió que los derivados de ciclopropano y ciclobutano son diferentes de ciclopentano y ciclohexano, porque sus\(\ce{C-C-C}\) ángulos no pueden tener el valor tetraédrico de\(109.5^\text{o}\). Al mismo tiempo, Baeyer planteó la hipótesis de que las dificultades encontradas para sintetizar anillos de cicloalcano desde\(\ce{C_7}\) arriba eran el resultado de la deformación angular que se esperaría si los anillos grandes fueran polígonos planos regulares (ver Tabla 12-3). Baeyer también creía que el ciclohexano tenía una estructura plana como la que se muestra en la Figura 12-2, lo que significaría que los ángulos de enlace tendrían que desviarse\(10.5^\text{o}\) del valor tetraédrico. Sin embargo, en 1895, el entonces desconocido químico H. Sachse sugirió que el ciclohexano existe en las formas de silla y barco libres de tensión discutidas en la Sección 12-3. Esta sugerencia no fue aceptada en ese momento porque condujo a la predicción de varios posibles isómeros para compuestos como el clorociclohexano. La idea de que tales isómeros pudieran actuar como una sola sustancia, como resultado de un rápido equilibrio, parecía una complicación innecesaria, y no fue hasta 1918 que E. Mohr propuso una forma definitiva de distinguir entre los ciclohexanos Baeyer y Sachse. Como se discutirá en la Sección 12-9, el resultado, ahora conocido como la teoría de Sachse-Mohr, fue la confirmación completa de la idea de anillos grandes no planares.
Cuadro 12-3: Tensión y Calores de Combustión de Cicloalcanos
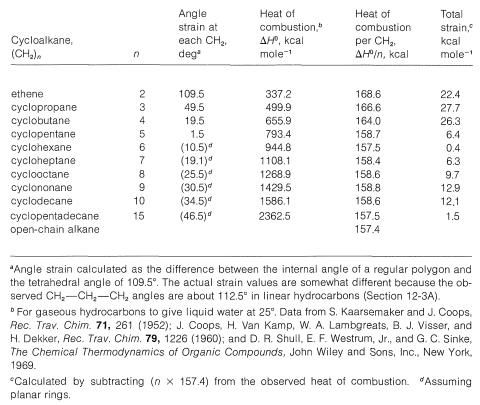
Debido a que el ciclopentano y el ciclobutano (Secciones 12-3E y 12-3F) también tienen anillos de carbono no planares, es claro que el postulado de Baeyer de anillos planos no es correcto. Sin embargo, la idea de deformación angular en anillos pequeños es importante. Hay mucha evidencia que demuestra que dicha cepa produce inestabilidad termodinámica y, por lo general, pero no siempre, una reactividad química mejorada.
Calores de Combustión de Cicloalcanos y Energías de Tensión
La deformación en compuestos de anillo puede evaluarse cuantitativamente comparando los calores de combustión por\(\ce{CH_2}\) grupo, como en la Tabla 12-3. Los datos indican que el ciclohexano está prácticamente libre de tensión, debido a que el calor de combustión per\(\ce{CH_2}\) es el mismo que para los alcanos\(\left( 157.4 \: \text{kcal mol}^{-1} \right)\). El aumento para los anillos más pequeños refleja claramente el aumento de la tensión angular y, hasta cierto punto, interacciones desfavorables entre los átomos no unidos. Para los anillos de\(\ce{C_7}\) a parece\(\ce{C_{12}}\) haber una tensión residual por cada adicional\(\ce{CH_2}\) de\(1\) a\(1.5 \: \text{kcal mol}^{-1}\). Estos anillos pueden ser frunciados en conformaciones flexibles con\(\ce{C-C-C}\) ángulos normales, pero como se mostrará en la Sección 12-6, desde\(\ce{C_7}\) hasta\(\ce{C_{13}}\) tales arreglos todos tienen pares de hidrógenos parcialmente eclipsados o interferentes. Los cicloalcanos más grandes como el ciclopentadecano parecen estar esencialmente libres de tensión.
Se espera que la cepa total en cicloalcanos del tipo\(\ce{(CH_2)}_n\) disminuya rápidamente en el orden\(n = 2 > n = 3 > n = 4\). Sin embargo, los datos del Cuadro 12-3 muestran que el orden en realidad es\(3 \cong 4 > 2\). Esta diferencia de orden a menudo se disfraza dividiendo los calores de combustión entre los números de\(\ce{CH_2}\) grupos y mostrando que los calores de combustión per\(\ce{CH_2}\) están al menos en el orden esperado de la deformación del ángulo de unión. Esta estratagema realmente no resuelve el problema.
Es importante reconocer que cuando evaluamos la tensión a partir de los calores de combustión por\(\ce{CH_2}\) grupo, estamos asumiendo que los\(\ce{C-H}\) enlaces tienen la misma fuerza, independientemente de\(n\). Sin embargo, las energías de unión-disociación de cada uno de los\(\ce{C-H}\) enlaces de eteno y ciclopropano son mayores que las de\(\ce{C_2-H}\) los enlaces de propano (Cuadro 4-6). Cualquier cantidad en la que estos enlaces sean más fuertes de lo normal hará que las energías de deformación juzgadas a partir de los calores de combustión parezcan ser menores. Si tomamos los\(\ce{C-H}\) enlaces para ser en promedio\(2 \: \text{kcal mol}^{-1}\) más fuertes en ciclobutano,\(6 \: \text{kcal mol}^{-1}\) más fuertes en ciclopropano y\(13 \: \text{kcal mol}^{-1}\) en eteno, podemos corregir las energías de tensión carbono-carbono en consecuencia. Para el ciclobutano la cepa corregida es entonces\(8 \times 2\) (para los ocho\(\ce{C-H}\) enlaces)\(+ \: 26.3\) (cepa total de la Tabla 12-3)\(= 42.3 \: \text{kcal mol}^{-1}\). Las cifras correspondientes para ciclopropano son\(6 \times 6 + 27.6 = 63.6 \: \text{kcal mol}^{-1}\), y para eteno,\(4 \times 13 + 22.4 = 74.4 \: \text{kcal mol}^{-1}\). Los resultados apoyan las expectativas intuitivas al dar mayores diferencias en la dirección correcta para las energías de tensión de ciclobutano, ciclopropano y eteno. Ya sea que este análisis sea cuantitativamente correcto o no, da alguna indicación de por qué la energía de deformación no es un concepto muy preciso, a menos que podamos estimar de manera confiable los efectos netos de una cepa.
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


