15.3: Propiedades espectroscópicas de los alcoholes
- Page ID
- 72984
El enlace hidrógeno-oxígeno de un grupo hidroxilo da una banda de absorción característica en el infrarrojo pero, como podemos esperar, esta absorción está considerablemente influenciada por los enlaces de hidrógeno. Por ejemplo, en el estado vapor (en el que esencialmente no hay enlaces de hidrógeno), el etanol da un espectro infrarrojo con una banda de absorción bastante aguda en\(3700 \: \text{cm}^{-1}\), debido a un grupo hidroxilo libre o no asociado (Figura 15-2a). En contraste, esta banda es apenas visible\(3640 \: \text{cm}^{-1}\) en el espectro de una\(10\%\) solución de etanol en tetracloruro de carbono (Figura 15-2b). Sin embargo, hay una banda relativamente ancha alrededor\(3350 \: \text{cm}^{-1}\), que es característica de los grupos hidroxilo unidos a hidrógeno. El cambio en la frecuencia de aproximadamente\(300 \: \text{cm}^{-1}\) surge porque los enlaces de hidrógeno debilitan el\(\ce{O-H}\) enlace; su frecuencia de absorción entonces será menor. La banda de asociación es amplia debido a que los grupos hidroxilo están asociados en agregados de diversos tamaños y formas. Esto produce una variedad de diferentes tipos de enlaces de hidrógeno y, por lo tanto, un espectro de frecuencias de\(\ce{O-H}\) absorción muy espaciadas.
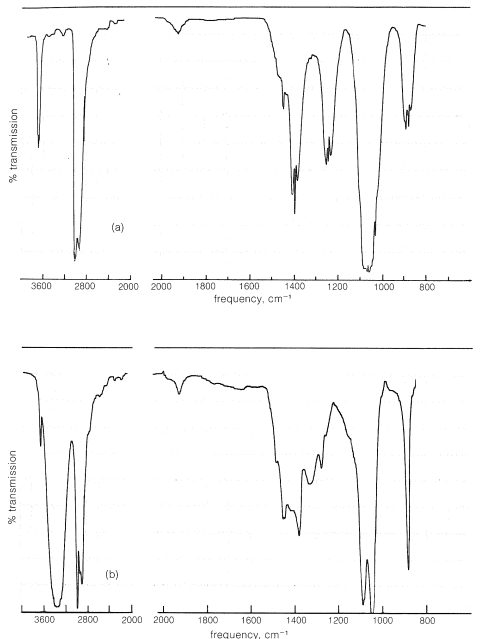
En soluciones muy diluidas de alcoholes en disolventes no polares, se minimiza el enlace de hidrógeno. Sin embargo, a medida que aumenta la concentración, cada vez más moléculas se asocian y la intensidad de la banda de absorción infrarroja debido a los grupos hidroxilo asociados aumenta a expensas de la banda de hidroxilo libre. Además, la frecuencia de la banda de asociación es una medida de la fuerza del enlace de hidrógeno. Cuanto menor es la frecuencia relativa a la posición del grupo hidroxilo libre, más fuerte es el enlace de hidrógeno. Como veremos en el Capítulo 18 el grupo hidroxilo en los ácidos carboxílicos\(\left( \ce{RCO_2H} \right)\) forma enlaces de hidrógeno más fuertes que los alcoholes y en consecuencia absorbe a frecuencias más bajas (menores en aproximadamente\(400 \: \text{cm}^{-1}\), ver Cuadro 9-2).
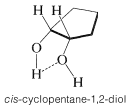
Los espectros infrarrojos de ciertos 1,2-dioles (glicoles) son interesantes ya que muestran absorción por enlaces de hidrógeno intramoleculares. Estas suelen ser bandas bastante afiladas en la región\(3450 \: \text{cm}^{-1}\) a\(3570 \: \text{cm}^{-1}\), y, en contraste con las bandas debidas a los enlaces de hidrógeno intermoleculares, no cambian de intensidad con la concentración. Un ejemplo típico lo proporciona cis-1,2-ciclopentandiol:
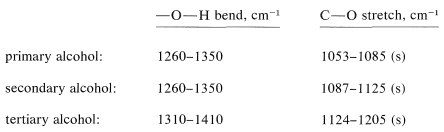
Además de las vibraciones de\(\ce{O-H}\) estiramiento de los alcoholes, hay una\(\ce{O-H}\) vibración de flexión normalmente observada en la región\(1410\) -\(1260 \: \text{cm}^{-1}\). También hay una fuerte vibración de\(\ce{C-O}\) estiramiento entre\(1210 \: \text{cm}^{-1}\) y\(1050 \: \text{cm}^{-1}\). Ambas bandas son sensibles a la estructura como se indica a continuación:
La influencia de los enlaces de hidrógeno en los espectros de RMN protónica de los alcoholes ha sido discutida previamente (Sección 9-10E). Puede recordar que el desplazamiento químico del\(\ce{OH}\) protón es variable y depende del grado de asociación a través de enlaces de hidrógeno; generalmente, cuanto más fuerte sea la asociación, menor será la intensidad de campo requerida para inducir resonancia. Los alcoholes también experimentan intercambio intermolecular de\(\ce{OH}\) protones, y la tasa de este intercambio puede influir en la forma de la línea de la\(\ce{OH}\) resonancia, el desplazamiento químico y la incidencia de división espín-espín, como se discute con más detalle en las Secciones 9-10E y 9-10I. En cuanto a los protones sobre el carbono que llevan el grupo hidroxilo, es decir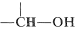 , son deshirados por el átomo de oxígeno que atrae electrones y en consecuencia tienen desplazamientos químicos algunos\(2.5\),\(3.0 \: \text{ppm}\) a campos más bajos que los protones alquílicos.
, son deshirados por el átomo de oxígeno que atrae electrones y en consecuencia tienen desplazamientos químicos algunos\(2.5\),\(3.0 \: \text{ppm}\) a campos más bajos que los protones alquílicos.
Quizás tenga curiosidad por saber por qué se observan absorciones en el espectro infrarrojo de alcoholes que corresponden tanto a grupos hidroxilo libres como enlazados por hidrógeno, mientras que solo se observa una\(\ce{OH}\) resonancia en sus espectros de RMN protónica. La explicación es que la vida útil de cualquier molécula en el estado libre o en el estado asociado es lo suficientemente larga para ser detectada por absorción infrarroja pero demasiado corta para ser detectada por RMN. En consecuencia, en la RMN solo se ve la\(\ce{OH}\) resonancia promedio de las especies no unidas a hidrógeno y unidas a hidrógeno presentes. La situación aquí es muy parecida a la observada para el equilibrio conformacional (Sección 9-10C).
Los máximos de absorción ultravioleta de longitud de onda más larga de metanol y metoximetano (éter dimetílico) se anotan en la Tabla 9-3. En cada caso el máximo de absorción, que probablemente implica una\(n \rightarrow \sigma^*\) transición, ocurre aproximadamente\(184 \: \text{nm}\), muy por debajo del corte de los espectrómetros comúnmente disponibles.
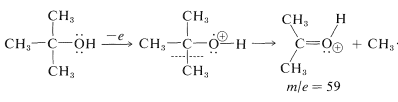
Los espectros de masas de los alcoholes no siempre muestran iones moleculares fuertes. La razón es que los\(\ce{M^+}\) iones se fragmentan fácilmente por\(\alpha\) escisión. Los iones fragmentos son relativamente estables y son las contrapartes gaseosas de aldehídos y cetonas protonadas:
Los éteres también se fragmentan por\(\alpha\) escisión:
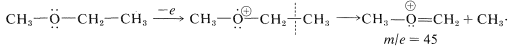
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


