15.4: Preparación de Alcoholes
- Page ID
- 73027
Muchos de los métodos comunes de laboratorio para la preparación de alcoholes han sido discutidos en post anterior o serán considerados posteriormente; así para evitar repeticiones indebidas no los consideraremos en detalle en este momento. Entre estos métodos se incluyen hidratación (Sección 10-3E) e hidroboración (Sección 11-6D), adición de ácidos hipohalosos a alquenos (Sección 10-4B)\(S_\text{N}1\) e\(S_\text{N}2\) hidrólisis de haluros de alquilo (Secciones 8-4 a 8-7) y de alílico y bencílico haluros (Secciones 14-3B y 14-3C), adición de reactivos de Grignard a compuestos carbonílicos (Sección 14-12), y la reducción de compuestos carbonílicos (Secciones 16-4E y 16-5). Estos métodos se resumen en la Tabla 15-2.
Algunas de las reacciones que hemos mencionado son utilizadas para la producción industrial a gran escala. Por ejemplo, el etanol se elabora en cantidad por la hidratación de eteno, utilizando un exceso de vapor bajo presión a temperaturas alrededor\(300^\text{o}\) en presencia de ácido fosfórico:
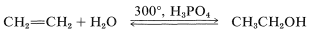
Se obtiene una solución diluida de etanol, la cual puede ser concentrada por destilación a una mezcla de punto de ebullición constante que contiene\(95.6\%\) etanol en peso. La deshidratación del poco porcentaje restante de agua para dar “alcohol absoluto” se logra ya sea por medios químicos o por destilación con benceno, lo que resulta en una separación preferencial del agua. El etanol también se elabora en grandes cantidades por fermentación, pero esta ruta no es competitiva para usos industriales con la hidratación del eteno. El alcohol isopropílico y el alcohol terc - butílico también se fabrican por hidratación de los alquenos correspondientes.
Cuadro 15-2: Métodos generales de preparación de alcoholes
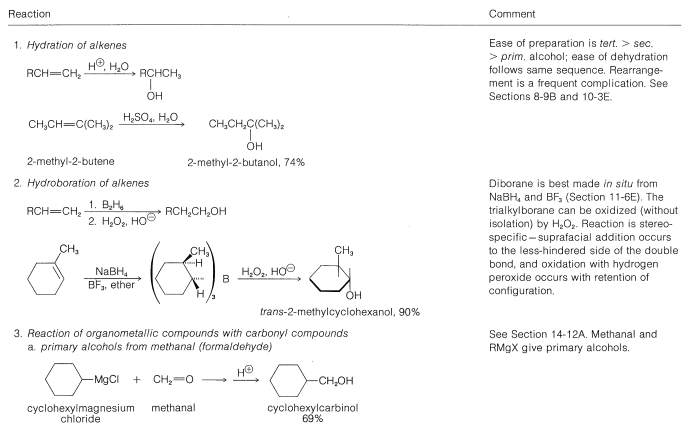
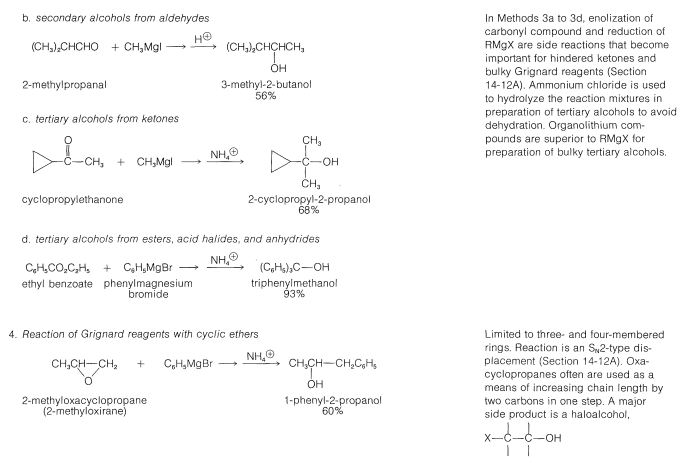
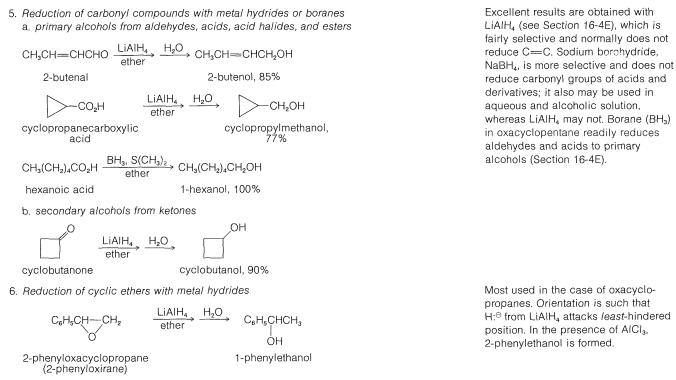
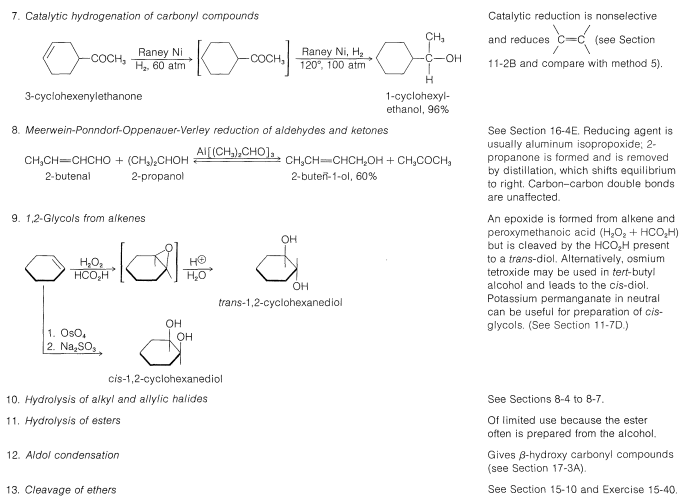
La síntesis industrial del alcohol metílico implica la hidrogenación de monóxido de carbono. Aunque esta reacción tiene el\(\Delta H^0\) valor favorable de\(-28.4 \: \text{kcal mol}^{-1}\), requiere altas presiones y altas temperaturas y un catalizador adecuado; se logran excelentes conversiones usando óxido de zinc-óxido crómico como catalizador:
En la Sección 16-4E se discutirán diversos métodos de síntesis de otros alcoholes por reducción de compuestos carbonílicos.
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


