19.3: Separación o Resolución de Enantiómeros
- Page ID
- 72991
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Debido a que las propiedades físicas de los enantiómeros son idénticas, rara vez se pueden separar por métodos físicos simples, como la cristalización fraccionada o la destilación. Es solo bajo la influencia de otra sustancia quiral que los enantiómeros se comportan de manera diferente, y casi todos los métodos de resolución de enantiómeros se basan en este hecho. Aquí incluimos una discusión sobre los principales métodos de resolución.
Aminas Quirales como Agentes Resolventes. Resolución de Ácidos Racémicos
El procedimiento más utilizado para separar enantiómeros es convertirlos en una mezcla de diastereómeros que tendrán diferentes propiedades físicas: punto de fusión, punto de ebullición, solubilidad, etc. (Sección 5-5). Por ejemplo, si tienes una\(L\) mezcla racémica o\(D\), de enantiómeros de un ácido y la conviertes en una sal con una base quiral que tenga la\(D\) configuración, la sal será una mezcla de dos diastereómeros, (\(D\)\(\cdot\)\(D\)ácido-base) y (\(L\)ácido \(\cdot\)\(D\)base). Estas sales diastereoméricas no son idénticas y no son imágenes especulares. Por lo tanto, diferirán en cierto grado en sus propiedades físicas, y puede ser posible una separación por métodos físicos, como la cristalización. Si las sales diastereoméricas pueden separarse completamente, el ácido regenerado a partir de cada sal será o bien exclusivamente el enantiómero\(D\) o bien el\(L\) enantiómero:
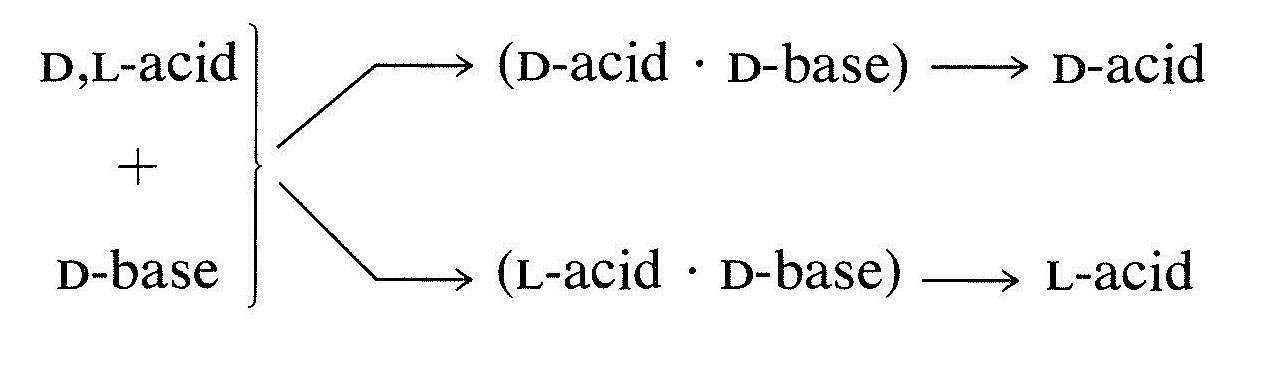
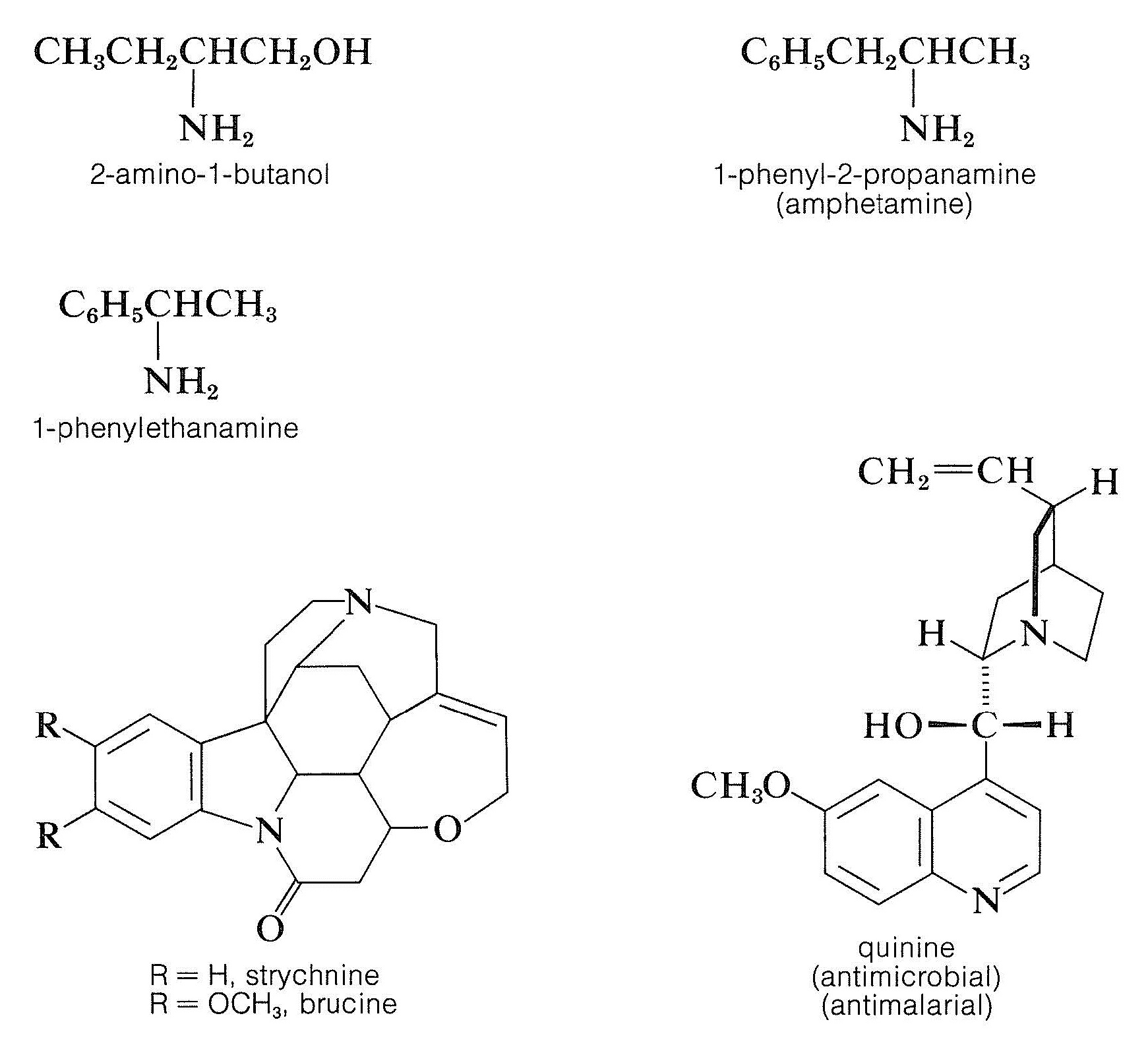
La resolución de ácidos quirales mediante la formación de sales diastereoméricas requiere suministros adecuados de bases quirales adecuadas. La brucina, la estricnina y la quinina se utilizan con frecuencia para este propósito porque son fácilmente disponibles, bases quirales de origen natural. También se pueden usar aminas más simples de origen sintético, como 2-amino-1-butanol, anfetamina y 1-feniletanamina, pero primero deben resolverse ellas mismas.
Resolución de Bases Racémicas
Los ácidos quirales, como el ácido\(\left( + \right)\) -tartárico, el ácido\(\left( - \right)\) -málico, el ácido\(\left( - \right)\) mandélico y el ácido\(\left( + \right)\) -canfor-10-sulfónico, se utilizan para la resolución de una base racémica.
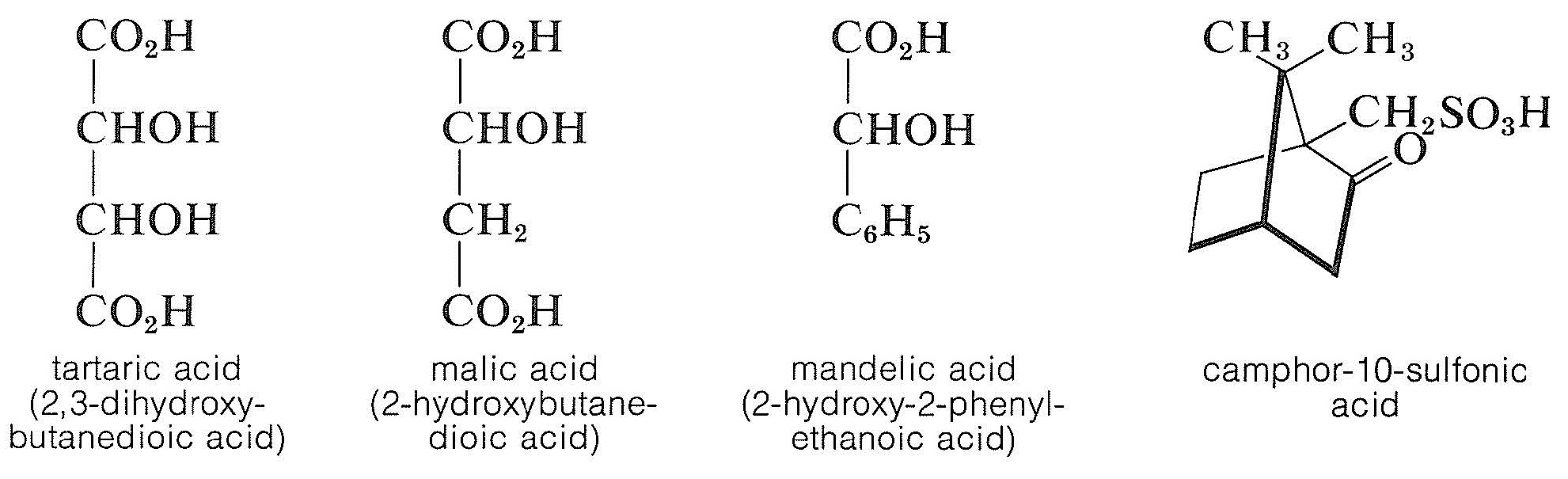
El principio es el mismo que para la resolución de un ácido racémico con una base quiral, y la elección del ácido dependerá tanto de la facilidad de separación de las sales diastereoméricas como, por supuesto, de la disponibilidad del ácido para la escala de la resolución involucrada. Los métodos de resolución de este tipo pueden ser tediosos, ya que pueden ser necesarias numerosas recristalizaciones en diferentes disolventes para enriquecer progresivamente los cristales en el diastereómero menos soluble. Para determinar cuándo se completa la resolución, la mezcla de diastereómeros se recristaliza hasta que no hay más cambios en la rotación óptica medida de los cristales. En esta etapa se espera que la sal cristalina sea un diastereómero puro del que pueda recuperarse un enantiómero puro. La rotación óptica de este enantiómero será un valor máximo si es “ópticamente” puro porque cualquier cantidad del otro enantiómero sólo podría reducir la magnitud de la rotación medida\(\alpha\).
Resolución de Alcoholes Racémicos
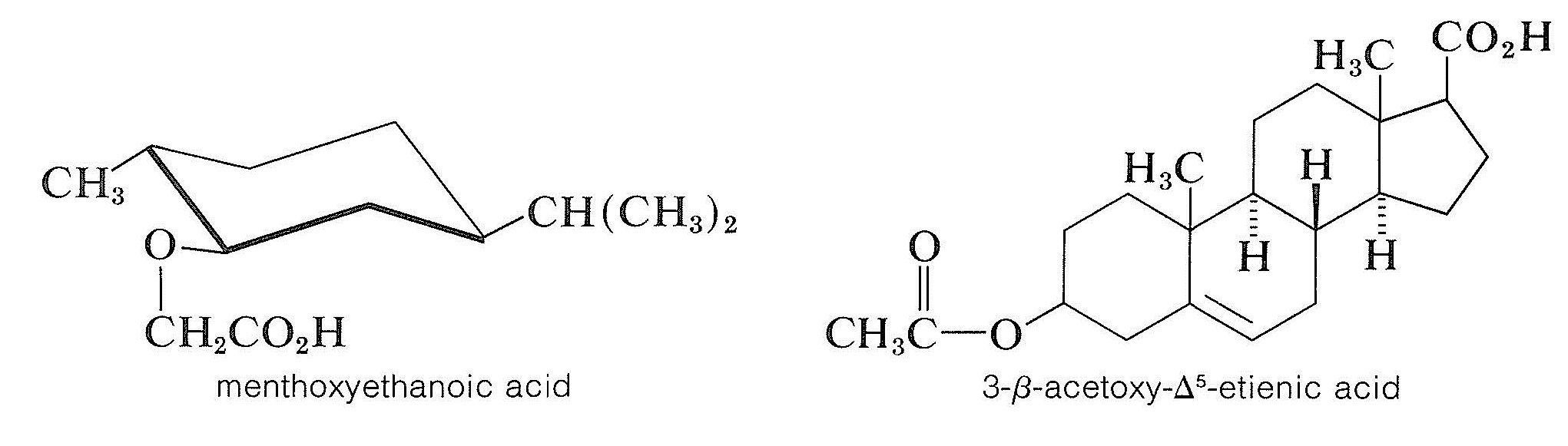
Para resolver un alcohol racémico, se puede usar un ácido quiral para convertir el alcohol en una mezcla de ésteres diastereoméricos. Esto no es tan generalmente útil como podría pensarse porque los ésteres tienden a ser líquidos a menos que sean compuestos de muy alto peso molecular. Si los ésteres diastereoméricos no son cristalinos, deben separarse por algún otro método que no sea la cristalización fraccionada (por ejemplo, por métodos de cromatografía, Sección 9-2). Dos ácidos quirales que son agentes de resolución útiles para alcoholes son:
El método más común para resolver un alcohol es convertirlo en un medio éster de un ácido dicarboxílico, como el ácido butanodioico (succínico) o 1,2-bencenodicarboxílico (ftálico), con el anhídrido correspondiente. El semiéster resultante tiene una función carboxilo libre y luego puede resolverse con una base quiral, generalmente brucina:
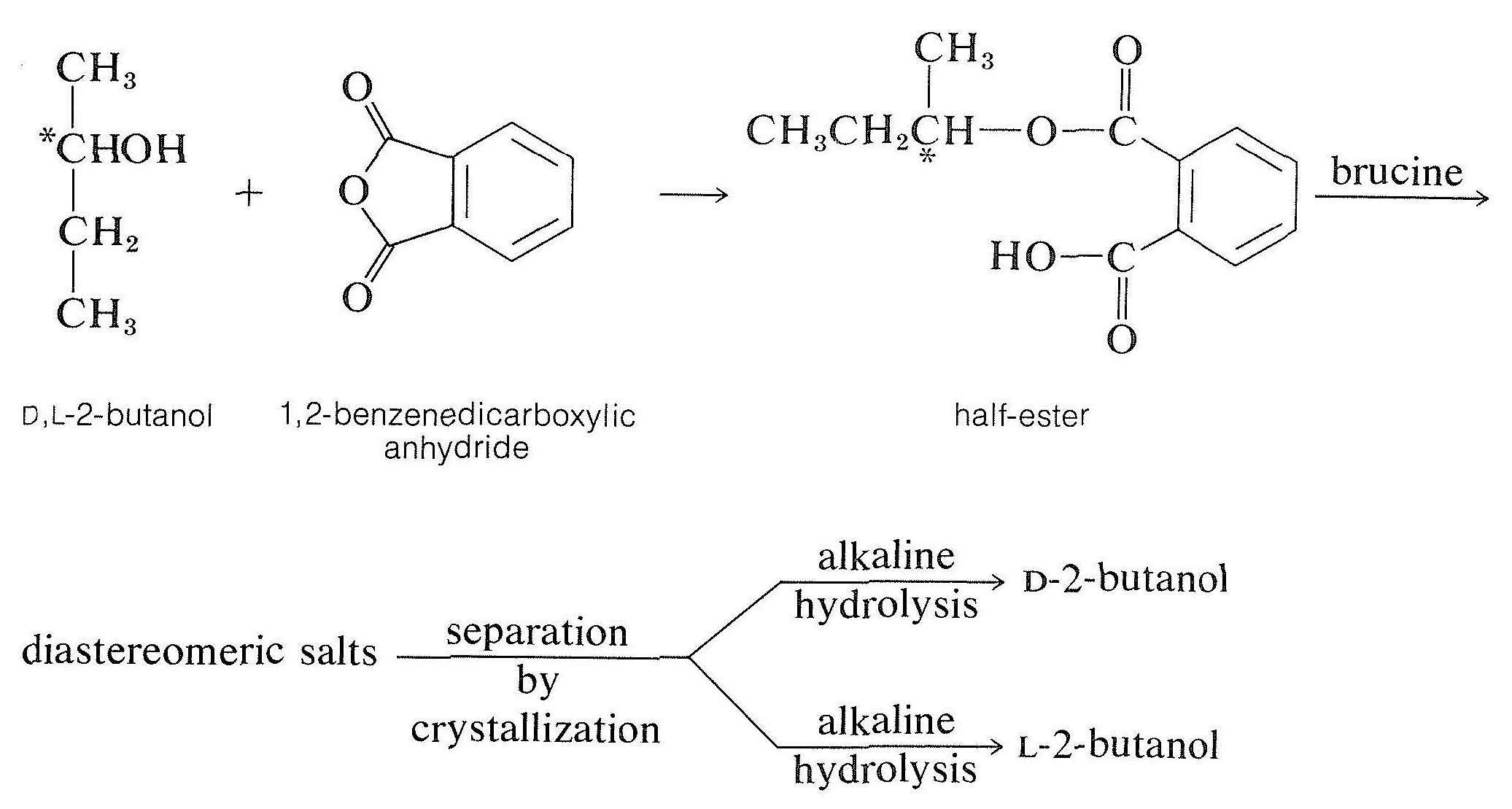
Otros Métodos de Resolución
Uno de los principales objetivos en el campo de la química orgánica es el desarrollo de reactivos con la propiedad de "reconocimiento quiral" tal que puedan efectuar una separación limpia de enantiómeros en una sola operación sin destruir ninguno de los enantiómeros. Aún no hemos logrado ese ideal, pero puede que no esté lejos en el futuro. Los métodos cromatográficos (Sección 9-2), mediante los cuales la fase estacionaria es un reactivo quiral que adsorbe un enantiómero más fuertemente que el otro, se han utilizado para resolver compuestos racémicos, pero tales resoluciones rara vez han conducido a ambos enantiómeros puros a escala preparativa.
Otros métodos, llamados resoluciones cinéticas, son excelentes cuando son aplicables. El procedimiento aprovecha las diferencias en las velocidades de reacción de enantiómeros con reactivos quirales. Un enantiómero puede reaccionar más rápidamente, dejando atrás un exceso del otro enantiómero. Por ejemplo, el ácido tartárico racémico puede resolverse con la ayuda de ciertos mohos de penicilina que consumen el enantiómero dextrorrotatorio más rápido que el enantiómero levorrotatorio. Como resultado, se puede recuperar ácido\(\left( - \right)\) tartárico casi puro de la mezcla:
\ (+\) más molde</p">
Una desventaja de las resoluciones de este tipo es que el enantiómero más reactivo generalmente no es recuperable de la mezcla de reacción.
El procedimiento de cristalización empleado por Pasteur para su resolución clásica\(\left( \pm \right)\) de ácido tartárico (Sección 5-1C) ha tenido éxito sólo en muy pocos casos. Este procedimiento depende de la formación de cristales individuales de cada enantiómero. Así, si la cristalización del tartrato de sodio y amonio se lleva a cabo a continuación\(27^\text{o}\), no se forma la sal racemato habitual; en su lugar se forma una mezcla de cristales del\(\left( + \right)\) y\(\left( - \right)\) sales. Los dos tipos diferentes de cristales, que están relacionados como un objeto con su imagen especular, se pueden separar manualmente con la ayuda de un microscopio y posteriormente pueden convertirse en los enantiómeros de ácido tartárico por ácido fuerte. Una variación de este método de resolución es la siembra de una solución saturada de una mezcla racémica con cristales de un enantiómero puro con la esperanza de provocar la cristalización de solo ese enantiómero, dejando así al otro en solución. Desafortunadamente, de esta manera se han logrado muy pocas resoluciones prácticas.
Incluso cuando se logra una resolución exitosa, quedan algunos problemas importantes. Por ejemplo, la propia resolución no proporciona información sobre la configuración real del\(\left( - \right)\) enantiómero\(\left( + \right)\) o. Esto debe determinarse por otros medios (ver Sección 19-5). Además, no es posible decir la pureza enantiomérica (pureza óptica) de los enantiómeros resueltos sin información adicional. Este punto se discute más a fondo en la siguiente sección.
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


