20.3: La estructura y propiedades de la D-glucosa
- Page ID
- 73097
Configuración
La glucosa es, con mucho, el monosacárido más abundante; se presenta libre en frutos, plantas, miel, en la sangre de animales, y combinada en muchos glucósidos, disacáridos y polisacáridos. La estructura y propiedades de la glucosa serán consideradas con mayor detalle que las de los otros monosacáridos, no sólo por su importancia, sino porque gran parte de lo que se puede decir sobre la glucosa también se puede decir de los otros monosacáridos.
La glucosa es una aldohexosa, lo que significa que es un azúcar de seis carbonos con un grupo aldehído terminal, mostrado por\(1\):
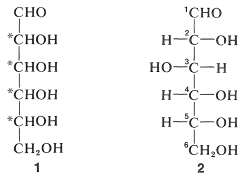
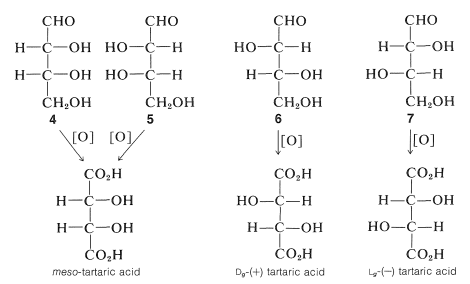
Los carbonos marcados con un asterisco en\(1\) son quirales; así hay\(2^4\), o dieciséis, posibles isómeros configuracionales. Todos son conocidos - algunos ocurren de forma natural y los otros han sido sintetizados (ver Cuadro 20-1). El problema de identificar la glucosa como una particular de las dieciséis posibilidades fue resuelto por Emil Fischer durante la última parte del siglo XIX, por lo que fue galardonado con el Premio Nobel de Química en 1902. Las configuraciones que dedujo para cada uno de los carbonos quirales,\(\ce{C_2}\) -\(\ce{C_5}\), se muestran en la fórmula de proyección\(2\). \(^2\)Si bien Fischer era consciente de que la glucosa natural podría ser el enantiómero de la Estructura\(2\), su suposición original sobre la configuración absoluta resultó ser correcta y la configuración en\(\ce{C_5}\) es la misma que la configuración del “azúcar” más simple\(D\) -\(\left( + \right)\) - gliceraldehído,\(3\), (ver Sección 19-5). Por lo tanto, la glucosa natural es específicamente\(D\) -glucosa:
La lógica completa de los procedimientos de Fischer para la determinación de la configuración de la glucosa está demasiado involucrada para ser explicada aquí en detalle. Lo que no podrá apreciar completamente son las grandes dificultades de trabajar con carbohidratos, es decir, su considerable solubilidad en agua, inestabilidad a agentes oxidantes fuertes y reactivos ácidos o básicos, renuencia a cristalizar y su tendencia a descomponerse en lugar de dar fusión aguda puntos. Afortunadamente para Fischer, muchas pentosas y hexosas diferentes ya estaban disponibles a partir de los esfuerzos de investigadores anteriores, y los principios de isomería óptica fueron bien entendidos como resultado del trabajo de van 't Hoff.
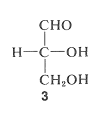
Dos de las ideas clave utilizadas por Fischer se pueden ilustrar mejor con aldotetrosas porque solo tienen dos carbonos quirales y muchas menos estructuras posibles a considerar. Escribiendo las cuatro posibilidades como el aldehído en lugar de estructuras hemiacetales, tenemos\(4\) -\(7\). De estos,\(4\) y\(5\) constituyen un par de enantiómeros, como lo hacen\(6\) y\(7\). Estos pares se pueden identificar mediante una cuidadosa oxidación de los grupos terminales para dar los correspondientes ácidos tartáricos (2,3-dihidroxibutanodioicos). Oxidación de ambos\(4\) y\(5\) da ácido meso-tartárico, mientras que la oxidación de\(6\) y\(7\) da, respectivamente,\(\left( + \right)\) y ácidos\(\left( - \right)\) tartáricos:
Debe quedar claro a partir de esto que las configuraciones de\(6\) y\(7\) se establecen al relacionarse con los respectivos ácidos tartáricos quirales. Sin embargo, no tenemos forma de decir cuál de las tetrosas representadas por\(4\) y\(5\) es\(D\) y cuál es\(L\), porque, en la oxidación, dan el mismo ácido tartárico aquiral. Lo que tenemos que hacer es relacionar uno u otro de los carbonos quirales de estas tetrosas con el carbono correspondiente de cualquiera\(6\) o\(7\). Una forma en que esto se puede hacer es mediante la degradación de Wohl, por lo que la longitud de la cadena se reduce en un carbono eliminando el carbono aldehído:

Aplicado a\(4\),\(5\)\(6\), y\(7\), la degradación de Wohl forma enantiómeros de gliceraldehído:

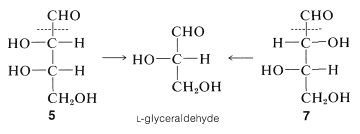
Aquí vemos eso\(4\) y\(6\) damos el mismo enantiómero,\(D\) -gliceraldehído, y por lo tanto tienen la misma configuración de su carbono asimétrico de mayor número. En contraste,\(5\) y\(7\) dar\(L\) -gliceraldehído y por lo tanto deben estar relacionados de manera similar. Mediante este tipo de procedimientos, las configuraciones de\(4\) a se\(7\) pueden establecer de manera inequívoca, aunque, como se podría imaginar, es mucho más fácil hacerlo en papel que en el laboratorio.
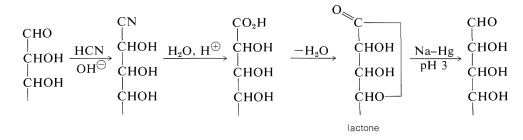
Conocer las configuraciones de las tetrosas ayuda a establecer las configuraciones de las pentosas. Así\(4\), mediante la síntesis de cianohidrina Kiliani-Fischer, se\(^3\) puede convertir en una mezcla de dos aldopentosas,\(8\) y\(9\), mediante la adición de un carbono en el extremo aldehído de la molécula. Las configuraciones de los dos carbonos en el extremo inferior de los materiales de partida permanecen sin cambios, pero se forman dos aldopentosas diastereoméricas en las síntesis debido a que se crea un nuevo centro quiral:
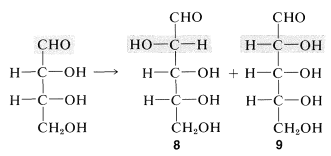
Los productos\(8\) y\(9\) presentan un nuevo problema configuracional, pero uno menos difícil que antes, debido a que ya se conocen las configuraciones de dos de los tres centros quirales. La oxidación controlada de\(8\) y\(9\) dará diferentes ácidos diastereoméricos 2,3,4-trihidroxipentanoicos,\(10\) y\(11\), respectivamente:

De estos,\(11\) es aquiral (meso), mientras que\(10\) es quiral. Por lo tanto, simplemente determinando qué producto de oxidación es ópticamente activo, y por lo tanto quiral, podemos asignar las configuraciones de\(8\) y\(9\). La comparación directa de estas aldopentosas sintéticas con los compuestos naturales podría usarse como prueba de la estructura de las aldopentosas naturales. Por este razonamiento\(8\) resulta ser\(D\) -arabinosa y\(9\) es\(D\) -ribosa.
Algunas de las reacciones clave en la química de carbohidratos implican la oxidación de las aldas a ácidos carboxílicos. Existe un sistema de nomenclatura simple para estos ácidos. En notación abreviada, los productos de oxidación en\(\ce{C_1}\)\(\ce{C_6}\), o ambos se llaman:
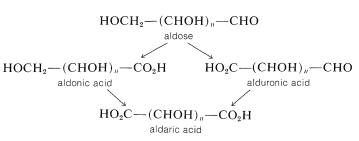
Los ácidos carboxílicos derivados de la glucosa son, por lo tanto, ácido glucónico, ácido glucurónico y ácido glucárico.
Formación Hemiacetal. Anómeros de Glucosa
Aunque la glucosa tiene algunas de las propiedades esperadas de un aldehído, carece de otras. Por ejemplo, forma ciertos derivados de carbonilo (por ejemplo, oxima y cianohidrina), y puede reducirse al hexahidroxihexano (sorbitol), y oxidarse con bromo a ácido glucónico (un ácido monocarboxílico). (Con ácido nítrico, la oxidación continúa para dar el ácido dicarboxílico, ácido\(D\) glucárico).
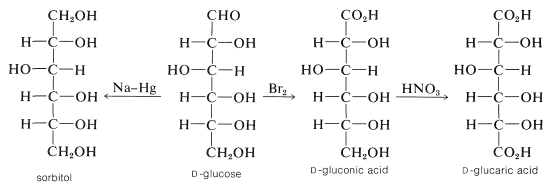
La glucosa también reducirá la solución de Fehling\(\left[ \ce{Cu} (II) \rightarrow \ce{Cu} (I) \right]\) y el reactivo de Tollen\(\left[ \ce{Ag} (I) \rightarrow \ce{Ag} (0) \right]\) y, por esta razón, se clasifica como un azúcar reductor. \(^4\)Sin embargo, no logra dar un compuesto de adición de sulfito de hidrógeno y, aunque reaccionará con aminas\(\left( \ce{RNH_2} \right)\), los productos no son las bases esperadas de Schiff del tipo\(\ce{-C=NR}\). Además, la glucosa forma dos derivados monometil diferentes (llamados\(D\) metil\(\alpha\) - glucósido y metil\(\beta\)\(D\) - glucósido) en condiciones que normalmente convierten un aldehído en un dimetilacetal:

Todas estas reacciones pueden explicarse sobre las bases de que el grupo carbonilo no está libre en glucosa sino que se combina con uno de los grupos hidroxilo, que resulta ser el que está en\(\ce{C_5}\), para formar un hemiacetal,\(12\) o\(13\). ¿Por qué son posibles dos hemiacetales? Debido a que se crea un nuevo centro asimétrico\(\ce{C_1}\) por la formación de hemiacetales, y esto conduce a formas diastereoméricas de\(D\) -glucosa llamadas\(\alpha\) -\(D\) -glucosa y\(\beta\) -\(D\) -glucosa. En general, los estereoisómeros de carbohidratos que difieren solo en configuración en el carbono hemiacetal se denominan anómeros:

Aunque las fórmulas\(12\) y\(13\) muestran las configuraciones en cada uno de los centros quirales, no proporcionan la información crucial para comprender las propiedades de la glucosa con respecto a la disposición de los átomos en el espacio. La conversión de una fórmula de proyección como\(12\) o\(13\) a una representación tridimensional no es en absoluto una tarea trivial. Hemos indicado el procedimiento para hacer en antes (Secciones 5-3C y 5-5). El resultado de estos procedimientos aplicados a\(12\) y\(13\) son las denominadas fórmulas de proyección de Haworth\(15\),\(14\) y, y las conformaciones de caballete,\(16\) y\(17\):
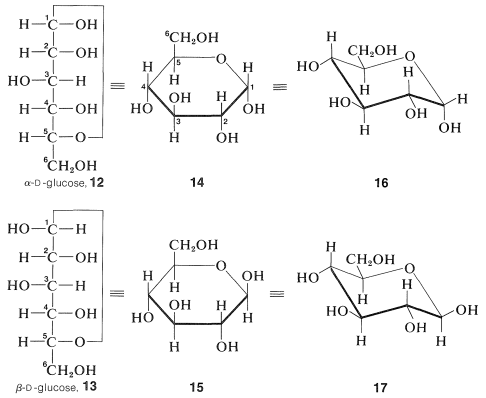
Debería poder satisfacerse de que la configuración en\(\ce{C_5}\) es la misma tanto en las representaciones de Fischer como en Haworth. Esto equivale a preguntar si\(18\) y\(19\) representar las mismas configuraciones:

Lo hacen, pero si tienes problemas para visualizar esto, te será muy útil usar un modelo de bola y palo para verlo\(18\) y\(19\) son representaciones diferentes de una misma configuración. Si no tienes modelos, recuerda que si la transposición de tres grupos cualquiera convierte una proyección en la otra, las fórmulas son idénticas. Así\(18\) y\(19\) tienen la misma configuración porque\(18\) se convierte\(19\) por transposición de\(\ce{C_4}\) con\(\ce{CH_2OH}\), luego\(\ce{C_4}\) con\(\ce{H}\).
Los estudios de rayos X de la\(D\) glucosa cristalina\(\alpha\)\(\beta\) - y - - muestran que estas moléculas tienen sus átomos dispuestos en el espacio como corresponden a\(16\) y\(17\). Esto es lo que esperaríamos de nuestros estudios de conformaciones de ciclohexano (Secciones 12-3A a 12-3D), porque para la\(\beta\) forma, todos los sustituyentes en el anillo de oxaciclohexano están en posiciones ecuatoriales, y para la\(\alpha\) forma, todos excepto el hidroxilo en el carbono anomérico\(\left( \ce{C_1} \right)\) son ecuatoriales.
Mutarotación de las Formas Anoméricas de Glucosa
Aunque las formas cristalinas de\(\alpha\) - y\(\beta\) -\(D\) -glucosa son bastante estables, en solución cada forma cambia lentamente en una mezcla de equilibrio de ambas. El proceso se puede observar como una disminución en la rotación óptica del\(\alpha\) anómero\(\left( +112^\text{o} \right)\) o un aumento para el\(\beta\) anómero\(\left( +18.7^\text{o} \right)\) al valor de equilibrio de\(52.5^\text{o}\). El fenómeno se conoce como mutarotación y comúnmente se observa para azúcares reductores. Tanto los ácidos como las bases catalizan la mutarotación; el mecanismo, Ecuación 20-1, es prácticamente el mismo que el descrito para los equilibrios hemiacetales y hemicetales catalizados por ácidos y bases de aldehídos y cetonas (ver Sección 15-4E):
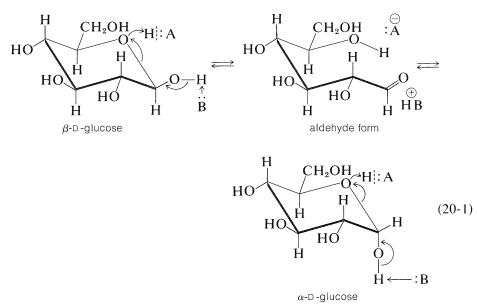
En equilibrio, están presentes alrededor\(64\%\)\(36\%\) del\(\beta\) anómero y del\(\alpha\) anómero. La cantidad de la forma de aldehído libre en equilibrio es muy pequeña (aproximadamente 0.024 por ciento en moles en solución neutra). La preponderancia del\(\beta\) anómero se atribuye al hecho de que la glucosa existe en solución en la conformación de la silla con el\(\ce{-CH_2OH}\) grupo grande ecuatorial. En esta conformación, el sustituyente hidroxilo at\(\ce{C_1}\) es ecuatorial en el\(\beta\) anómero y axial en el\(\alpha\) anómero; de ahí que el\(\beta\) anómero sea ligeramente más estable. Cuando la glucosa está en forma de aldehído, el hidroxilo\(\ce{C_4}\) también podría agregarse al aldehído carbonilo para producir un hemiacetal con un anillo de cinco miembros. Esto no ocurre en un grado significativo con la glucosa debido a que el hemiacetal con el anillo de seis miembros y muchos grupos ecuatoriales es más estable. Con otros azúcares, se producen mezclas de anillos hemiacetales o cetales de cinco y seis miembros y sus respectivos anómeros en solución acuosa.
Los espectros de RMN de carbono 13 (Sección 9-10L) proporcionan una herramienta especialmente poderosa para estudiar las formas anoméricas de los azúcares. Por ejemplo, con glucosa las resonancias de\(\ce{C_1}\)\(\ce{C_3}\), y\(\ce{C_5}\) del\(\alpha\) anómero se ven en la Figura 20-3 que se desplazan sustancialmente campo arriba con respecto a las del\(\beta\) anómero debido al efecto sustituyente axial (Sección 12-3D).

Reordenamientos de aldosa\(\leftrightharpoons\) cetosa
En presencia de base diluida,\(D\) -glucosa se reorganiza a una mezcla que contiene los anómeros de\(D\) -glucosa\(\left( \sim 64\% \right)\),\(D\) -fructosa\(\left( \sim 31\% \right)\) y\(D\) -manosa\(\left( 3\% \right)\). Esta interconversión implica indudablemente la enolización de las hexosas por medio de un intermedio de enodiol común de acuerdo con la Ecuación 20-2:
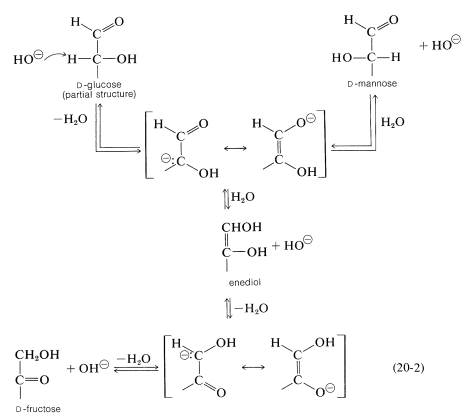
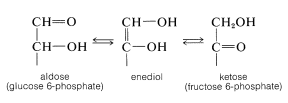
El reordenamiento es de interés porque la interconversión enzimática correspondiente de aldosas y cetosas es una parte importante de las vías biosintéticas, fotosintéticas y metabólicas, como veremos en la Sección 20-9. Aunque el reordenamiento bioquímico también puede proceder por medio de intermedios de enodiol, es altamente estereoespecífico y produce solo una de las dos posibles aldosis estereoisoméricas. Por ejemplo, la glucosa, pero no la manosa, se puede interconvertir enzimáticamente con fructosa como el derivado del éster 6-fosfato:
\(^3\)Los pasos de la síntesis Kiliani-Fischer son:
\(^4\)En general, los azúcares reductores son hemiacetales o hemicetales y los azúcares no reductores son acetales o cetales. La diferencia es entre la presencia de los elementos estructurales\(\ce{C-O-C-O-H}\) y\(\ce{C-O-C-O-C}\).
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


