20.7: Disacáridos
- Page ID
- 73086
Tipos generales y propiedades
Las combinaciones de dos o más de los azúcares simples a través de enlaces glucósidos dan sustancias conocidas como polisacáridos. También se les llama oligosacáridos si están hechos de dos a diez unidades de azúcar. Los oligosacáridos más simples son los disacáridos hechos de dos moléculas de azúcares simples que se pueden unir con enlaces\(\ce{O}\) glucósidos, y probablemente sea más fácil visualizarlos como se muestra en las fórmulas “desmenuzadas”,\(22\) y\(23\):
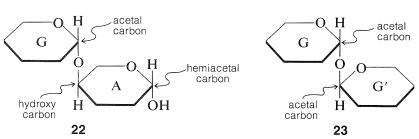
Debes mirar\(22\) y\(23\) cuidadosamente para estar seguro de que reconoces la diferencia entre ellos. \(^5\)En\(22\), el azúcar A está actuando como un simple compuesto hidroxi, la aglicona del azúcar G a la que está unida por un enlace\(\ce{O}\) -glucósido. \(^6\)La hidrólisis\(22\) del enlace glucósido procederá de la siguiente manera:
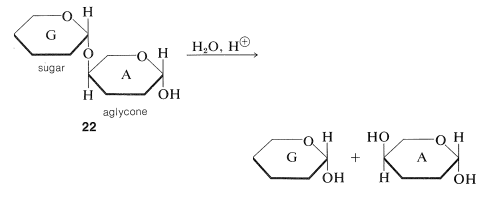
Disacáridos como\(22\) son como la glucosa en ser azúcares reductores (Sección 20-2B), porque el Componente A tiene el agrupamiento hemiacetal que se abre fácilmente a la forma aldehído en las condiciones ligeramente alcalinas utilizadas para las oxidaciones en solución de Tollen y Fehling. Debido a que hay un grupo hemiacetal libre, los azúcares reductores también forman osazonas y mutarotan (Secciones 20-4B y 20-2C).
Los disacáridos de tipo\(23\) son diferentes en que cada azúcar, G y G', está actuando tanto como azúcar glucósido como aglicona. El vínculo entre ellos es el de un acetal de doble cañón\(\ce{-O-C-O-C-O}-\), y no hay agrupamiento hemiacetal en la molécula. Por lo tanto, estos son azúcares no reductores en lo que respecta a las pruebas estándar. Sin embargo, la hidrólisis de los enlaces\(\ce{O}\) -glucósido de\(23\) sí genera azúcares reductores con carbonos hemiacetales:

En general, encontramos que los disacáridos no reductores no dan ninguna de las reacciones carbonílicas observadas para la glucosa, como la mutarotación y la formación de osazona, excepto cuando las condiciones son suficientemente ácidas para hidrolizar el enlace acetal.
Entre los disacáridos más importantes se encuentran la sacarosa\(24\), la maltosa\(25\), la celobiosa y la lactosa,\(27\):\(26\)

La sacarosa y la lactosa se presentan ampliamente como azúcares libres, lactosa en la leche de mamíferos y sacarosa en frutos y plantas (especialmente en caña de azúcar y remolacha azucarera). La maltosa es el producto de la hidrólisis enzimática del almidón, y la celobiosa es un producto de la hidrólisis de la celulosa.
Para establecer completamente la estructura de un disacárido, debemos determinar (1) la identidad de los monosacáridos componentes; (2) el tipo de unión anular, furanosa o piranosa, en cada monosacárido, tal y como existe en el disacárido; (3) las posiciones que unen un monosacárido con el otro; y (4) la configuración anomérica (\(\alpha\)o\(\beta\)) de este enlace.
La hidrólisis de disacáridos con enzimas es muy útil para establecer configuraciones anoméricas, ya que las enzimas son catalizadores altamente específicos para la hidrólisis de los diferentes tipos de enlaces glicosídicos. Por ejemplo,\(\alpha\) -\(D\) -glucosidasa (maltasa) cataliza la hidrólisis de\(\alpha\) -\(D\) -glucósidos más rápidamente que de\(\beta\) -\(D\) -glucósidos. La enzima emulsina (que se encuentra en las almendras amargas) en contraste muestra una fuerte preferencia por los\(\beta\)\(D\) -glucósidos sobre los\(\alpha\)\(D\) -glucósidos. La invertasa de levadura cataliza la hidrólisis de\(\beta\)\(D\) -fructósidos.
Estructura de la Sacarosa
Sabemos que la sacarosa consiste en los dos monosacáridos glucosa y fructosa porque la hidrólisis con ácidos o enzimas da cantidades iguales de cada hexosa. Además, la sacarosa no es un azúcar reductor, no forma ningún derivado de fenilosazona y no mutarota. Por lo tanto, los carbonos anoméricos tanto de la glucosa como de la fructosa deben unirse a través de un puente de oxígeno en sacarosa. Así, la sacarosa es un glucosil fructósido o, igualmente, un fructosil glucósido.
Debido a que la sacarosa es hidrolizada por enzimas que ayudan específicamente a la hidrólisis de ambos\(\alpha\) glucósidos (como la\(\alpha\) glucosidasa de levadura) y\(\beta\) -fructósidos (como la invertasa), se infiere que el residuo de glucosa está presente como\(\alpha\) glucósido y el residuo de fructosa como\(\beta\) fructósido. Si es así, la incertidumbre restante en la estructura de la sacarosa es el tamaño de los anillos en los residuos de glucosa y fructosa.
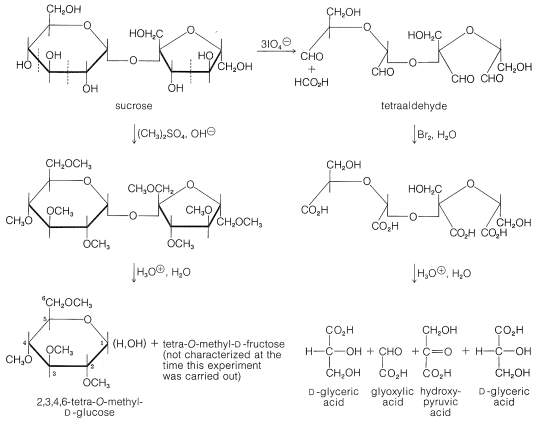
El tamaño de los anillos de azúcar en sacarosa ha sido determinado por las reacciones mostradas en la Figura 20-5. La metilación de sacarosa con sulfato de dimetilo en solución básica seguida de hidrólisis del derivado octametilo da 2,3,4,6-tetra-\(\ce{O}\) metil-\(D\) glucopiranosa (Sección 20-4) y una tetra-\(\ce{O}\) -metil-\(D\) fructosa. Esto establece que la glucosa reside en sacarosa como glucopiranosa. El residuo de fructosa debe ser una fructofuranosa porque la oxidación de la sacarosa con peryodato consume tres moles de peryodato, por lo que se forman un mol de ácido metanoico y un mol de un tetraaldehído. En la oxidación del bromo seguida de hidrólisis ácida, el tetraaldehído da ácido 3-hidroxi-2-oxopropanoico (ácido hidroxipirúvico\(\ce{HOCH_2COCO_2H}\)), ácido oxoetanoico (ácido glioxílico\(\ce{OCHCO_2H}\)) y ácido\(D\) glicérico\(\left( \ce{HOCH_2CHOHCO_2H} \right)\). Por lo tanto\(24\), la sacarosa tiene estructura, y esta estructura fue confirmada por síntesis (R. Lemieux en 1953).
\(^5\)Por ahora, ignoraremos la posibilidad de diferentes anómeros del disacárido o sus azúcares componentes.
\(^6\)La manera en que los azúcares se unen entre sí para formar oligosacáridos fue dilucidada por W. N. Haworth, quien recibió el Premio Nobel de Química en 1937 por esta y otras contribuciones a la investigación sobre las estructuras y reacciones de los carbohidratos.
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


