24.1: Características estructurales, físicas y espectrales de las amidas
- Page ID
- 73282
Estructura Molecular
Los parámetros estructurales del grupo amida se han determinado cuidadosamente y el siguiente diagrama da una idea razonable de las dimensiones moleculares:
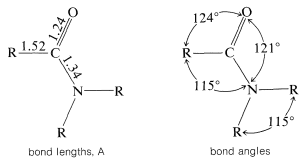
Una característica importante del grupo es que es plano: el carbono, oxígeno, nitrógeno y el primer átomo de cada uno de los\(\ce{R}\) grupos sobre carbono y nitrógeno se encuentran en el mismo plano. La distancia de\(\ce{C-N}\) unión de\(1.34 \: \text{Å}\) es intermedia entre la\(\ce{C-N}\) distancia de enlace simple típica de\(1.47 \: \text{Å}\) y la\(\ce{C=N}\) distancia de doble enlace de\(1.24 \: \text{Å}\). Esta y otras evidencias indican que el grupo amida es una estructura híbrida de las formas de enlace de valencia\(1a\) y\(1b\), con energía de estabilización de aproximadamente\(18 \: \text{kcal mol}^{-1}\):
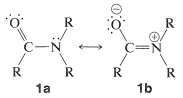
Se requiere coplanaridad para que la estructura dipolar\(1b\) sea significativa. Se puede esperar un momento dipolar apreciable de las amidas y, de hecho, las amidas simples tienen momentos dipolares en el rango de 3.7-3.8 debye. (Para referencia, el grupo carbonilo tiene un momento de aproximadamente 2.7 debye, Sección 16-1B.)
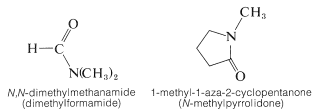
Como consecuencia de la polaridad del grupo amida, las amidas de bajo peso molecular son relativamente de alto punto de fusión y solubles en agua, en comparación con ésteres, aminas, alcoholes y similares. Los pocos que son líquidos, como\(\ce{N}\),\(\ce{N}\) -dimetilmetanamida y 1-metil-1-aza-2-ciclopentanona, tienen excelentes propiedades solventes tanto para sustancias polares como no polares. Por lo tanto, son buenos disolventes para reacciones de desplazamiento del\(S_\text{N}\) tipo (Cuadro 8-5).
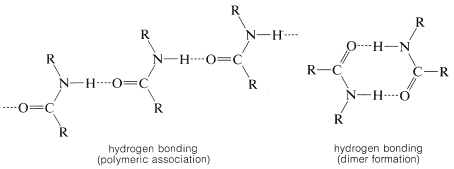
Otra consecuencia muy importante de la estructura amida es la extensa asociación molecular de amidas a través de enlaces de hidrógeno. Los oxígenos relativamente negativos actúan como aceptores de hidrógeno mientras que\(\ce{N-H}\) los hidrógenos sirven como donantes de hidrógeno:
Nomenclatura
El nombre de las amidas se resume en la Sección 7-7D. Los puntos a recordar son que generalmente se nombran ya sea como (i) alcanamidas, en las que el prefijo alcano (e) está determinado por la cadena carbonada más larga que incluye el grupo carbonilo (\(\ce{HCONH_2}\)es metanamida), o como (ii) carboxamidas sustituidas, \(\ce{RCONH_2}\), en el que se completa el nombre identificando al\(\ce{R}\) sustituyente:

El grado de sustitución en el nitrógeno de la amida determina si la amida es primaria\(\ce{RCONH_2}\)\(\ce{RCONHR}\), secundaria o terciaria\(\ce{RCONR_2}\). Cuando la amida es secundaria o terciaria, el símbolo\(\ce{N}\) (para nitrógeno) debe preceder al nombre de cada grupo diferente unido al nitrógeno:
Espectros infrarrojos
Se dispone de considerable información sobre los espectros infrarrojos de las amidas. A modo de ejemplo, los espectros de tres amidas típicas con diferentes grados de sustitución sobre nitrógeno se muestran en la Figura 24-1.
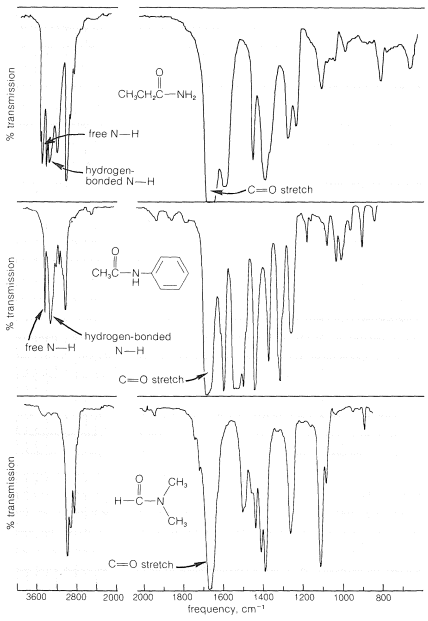
Una fuerte absorción de carbonilo es evidente en los espectros de todas las amidas, aunque la frecuencia de absorción varía algo con la estructura de la amida. Por lo tanto, las amidas primarias generalmente absorben cerca\(1680 \: \text{cm}^{-1}\), mientras que las amidas secundarias y terciarias absorben a frecuencias ligeramente menores. Las frecuencias de\(\ce{N-H}\) estiramiento de las amidas son muy similares a las de las aminas y muestran cambios de\(100 \: \text{cm}^{-1}\)\(200 \: \text{cm}^{-1}\) a frecuencias más bajas como resultado de los enlaces de hidrógeno. Las amidas primarias tienen dos\(\ce{N-H}\) bandas de intensidad media cerca\(3500 \: \text{cm}^{-1}\) y\(3400 \: \text{cm}^{-1}\), mientras que las amidas secundarias, a una primera aproximación, solo tienen una\(\ce{N-H}\) banda cercana\(3440 \: \text{cm}^{-1}\). Sin embargo, una mirada más cercana revela que el número, posición e intensidad de las\(\ce{N-H}\) bandas de amidas monosustituidas dependen de la conformación de la amida, que puede ser cis o trans:
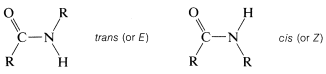
Normalmente, la configuración trans es más estable que la conformación cis para las amidas primarias. Sin embargo, para las amidas cíclicas (lactamas), en las que el tamaño del anillo es pequeño, la configuración es exclusivamente cis:
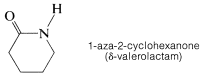
Espectros de RMN
Las resonancias de RMN de protones de los\(\ce{N-H}\) protones de amidas son diferentes a las que hemos discutido hasta ahora. Generalmente, estos aparecerán a temperatura ambiente como una amplia absorción singlete, que puede convertirse en un triplete amplio a temperaturas más altas. Un ejemplo típico es la propanamida (Figura 24-2).
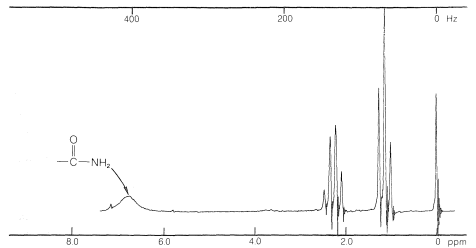
La amplia resonancia de\(\ce{N-H}\) protones se debe a las propiedades nucleares especiales del isótopo natural predominante del nitrógeno.\(\ce{^{14}N}\) Esto se establece más allá de toda duda mediante la observación del espectro protónico de una amida en la que el\(\ce{^{14}N}\) es reemplazado por el\(\ce{^{15}N}\) isótopo para dar\(\ce{RCO} \ce{^{15}N} \ce{H_2}\). En este caso las líneas de protones son afiladas. Los detalles de los fenómenos que conducen a las amplias resonancias de los\(\ce{N-H}\) protones en las amidas se discuten en otra parte;\(^1\) para nuestros propósitos debería bastar señalar que el\(\ce{^{14}N}\) núcleo tiene tiempos de vida mucho más cortos para sus estados magnéticos que los protones, y las líneas anchas resultan de incertidumbres en la vida de los estados asociados al acoplamiento\(\ce{^{14}N} \ce{-H}\) espín-espín (Sección 27-1). Uno debe estar preparado para absorciones de este carácter en amidas y algunas otras sustancias con\(\ce{N-H}\) enlaces que no están involucrados en intercambios intermoleculares rápidos de protones, que cuando son suficientemente rápidos, tienen el efecto de promediar los efectos magnéticos de los\(\ce{^{14}N}\) átomos a cero:
\[\ce{R'NH_2} + \ce{R} \overset{\oplus}{\ce{N}} \ce{H_3} \rightleftharpoons \ce{R'} \overset{\oplus}{\ce{N}} \ce{H_3} + \ce{RNH_2}\]
o
\[\ce{R'NH_2} + \ce{R} \overset{\ominus}{\ce{N}} \ce{H} \rightleftharpoons \ce{R'} \overset{\ominus}{\ce{N}} \ce{H} + \ce{RNH_2}\]
La situación aquí es análoga a la discutida para la división de las resonancias de\(\ce{O-H}\) protones de alcoholes por protones en los\(\alpha\) carbonos (ver Sección 9-10I).
Los espectros de RMN de las amidas son reveladores en cuanto a la estructura del grupo amida. Por ejemplo, el espectro de\(\ce{N}\),\(\ce{N}\) -dimetilmetanamida muestra dos resonancias simples de tres protones en\(2.78 \: \text{ppm}\) y\(2.95 \: \text{ppm}\), lo que significa que a temperaturas ordinarias los dos grupos metilo en el nitrógeno no están en el mismo ambiente molecular:
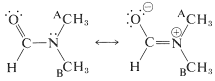
Esto es una consecuencia del carácter de doble enlace del\(\ce{C-N}\) enlace esperado de las estructuras de enlace de valencia\(1a\) y\(1b\), lo que conduce a una rotación restringida alrededor de este enlace. Uno de los grupos metilo (A) tiene una relación estereoquímica diferente al grupo carbonilo que el otro grupo metilo (B). Por lo tanto, los grupos A y B tendrán diferentes desplazamientos químicos, siempre que la rotación alrededor del\(\ce{C-N}\) enlace sea lenta. Sin embargo, en\(150^\text{o}\) las dos líneas de tres protones se encuentran que se unen a una sola línea de seis protones, lo que significa que a esta temperatura la rotación del enlace es lo suficientemente rápida como para hacer que los grupos metilo sean esencialmente indistinguibles (ver Sección 9-10C):
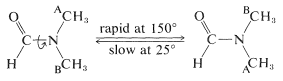
La mayoría de las amidas no giran libremente alrededor del\(\ce{C-N}\) enlace. La barrera a este tipo de rotación es aproximadamente\(19 \: \text{kcal mol}^{-1}\), la cual es lo suficientemente alta como para que la no equivalencia de grupos sobre nitrógeno sea observable por técnicas espectrales, pero no lo suficientemente alta como para permitir la separación física real de isómeros\(E,Z\) configuracionales estables.
\(^1\)J. D. Roberts, Resonancia Magnética Nuclear, Aplicaciones a la Química Orgánica, McGraw-Hill Book Co., Nueva York, 1959, Capítulo 5. Ver también las referencias de RMN al final del Capítulo 9 de este libro.
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


