24.2: Amidas como ácidos y bases
- Page ID
- 73243
Acidez
Las amidas con\(\ce{N-H}\) enlaces son débilmente ácidas,\(K_a\) siendo lo habitual sobre\(10^{-16}\):
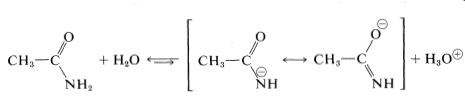
Sin embargo, las amidas son claramente mucho más ácidas que el amoníaco\(\left( K_a \sim 10^{-33} \right)\), y esta diferencia refleja un grado sustancial de estabilización del anión amida. Sin embargo, las amidas siguen siendo ácidos muy débiles (aproximadamente tan débiles como el agua) y, para fines prácticos, se consideran compuestos neutros.
Donde existen dos grupos carbonilo para estabilizar el anión amida, como en el anión 1,2-bencenodicarboximida (ftalimida) (Sección 18-10C), la acidez aumenta notablemente y las imidas pueden convertirse en sus bases conjugadas con ion hidróxido acuoso concentrado. Hemos visto cómo las sales de imida pueden ser utilizadas para la síntesis de aminas primarias. (Síntesis de Gabriel, Sección 23-9D y Cuadro 23-6).
Basicidad
El grado de basicidad de las amidas es mucho menor que el de las aminas alifáticas. Para la etanamida,\(K_b\) es aproximadamente\(10^{-15}\) (\(K_a\)del ácido conjugado es\(\sim 10\)):
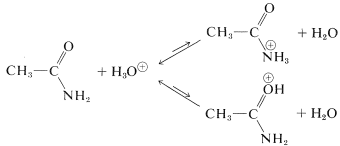
El protón se puede unir ya sea al nitrógeno o al oxígeno, y la elección entre las asignaciones no es fácil. Por supuesto, el nitrógeno es intrínsecamente más básico que el oxígeno; pero la formación del ácido\(\ce{N}\) conjugado provocaría la pérdida de toda la energía de estabilización de amida. La adición al oxígeno en realidad es favorecida, pero las amidas son demasiado débilmente básicas para que la protonación ocurra en alguna medida en la solución acuosa.
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


