1.5: Polímeros de coordinación
- Page ID
- 71946
Los polímeros son moléculas de cadena larga formadas a partir de bloques de construcción moleculares individuales. Por lo general, los bloques de construcción son moléculas orgánicas unidas a través de enlaces covalentes. ¿Qué otros tipos de bloques de construcción están disponibles?
La formación de compuestos de coordinación es uno de los muchos aspectos importantes de la química inorgánica. En un compuesto de coordinación, un donante de pares de electrones, llamado ligando, comparte su par de electrones con un átomo metálico. Frecuentemente, el átomo metálico es un metal de transición, y muy comúnmente es un ion de metal de transición, pero también hay otros ejemplos.
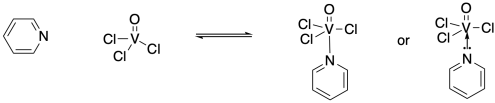
Por ejemplo, el nitrógeno en un anillo de piridina tiene un par solitario. La piridina puede actuar como ligando si su par solitario se comparte con un centro metálico, como el vanadio en tricloro (oxo) vanadio. El par solitario se convierte en un enlace nitrógeno-vanadio. En ocasiones, este vínculo se dibuja como una flecha corta desde el par solitario hasta el vanadio, enfatizando su origen, pero más a menudo simplemente se dibuja como una línea, como cualquier otro vínculo.
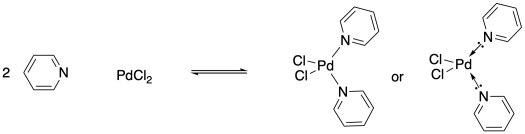
Una de las cosas interesantes de los átomos metálicos es su capacidad para formar números variables de enlaces. Aunque el dicloruro de paladio podría formar un complejo de coordinación al unirse con un ligando de piridina, también puede hacerlo con dos piridinas. En el primer caso, formaría un complejo de tres coordenadas, pero el último caso conduciría a un compuesto de paladio de cuatro coordenadas.
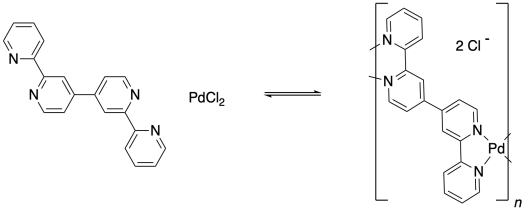
Recuerde, la capacidad de unirse con dos grupos vecinos, en lugar de solo uno, es una característica importante que puede permitir que una pequeña molécula quede encantada en un polímero. El paladio aquí es un eslabón en una cadena de tres unidades de largo. ¿Y si el ligando también tuviera esta capacidad de unirse a dos cosas? ¿Y si, en lugar de piridina, el ligando fuera 4,4'-bipiridina?
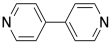
Esa molécula podría unirse a un átomo de paladio en cualquier extremo. Una vez que un bpy (eso es una abreviatura de bipiridina, pronunciado “bippy”) unido a un átomo de paladio, todavía tendría un segundo par solitario de nitrógeno que podría usar para unirse a otro. El paladio, también, sería libre de unir un segundo bpy. Como resultado, estas dos unidades monoméricas son capaces de formar una cadena alterna.
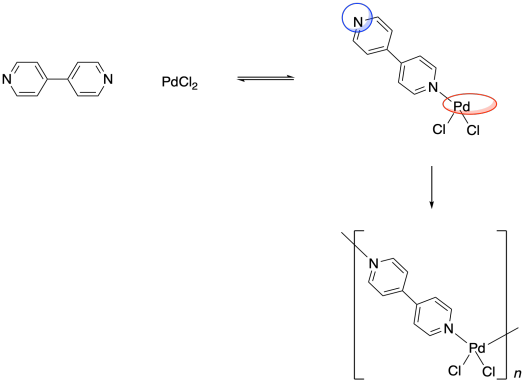
¿Por qué la gente querría hacer eso? La idea general es explotar las propiedades de estos átomos metálicos de nuevas maneras. ¿En qué sirven los metales? Son buenos para conducir electricidad y, a veces, tienen propiedades magnéticas útiles. Si estas propiedades se pueden incorporar a un material que se parece más a los polímeros orgánicos, que tienden a ser económicos y muy ligeros, entonces tal vez se puedan utilizar para hacer materiales que tendrán todo tipo de aplicaciones en la vida cotidiana. Los metales también son muy buenos catalizadores para una amplia gama de reacciones. Un polímero de coordinación sirve para separar los átomos metálicos de manera uniforme dentro de una estructura que tiene mucha área de superficie, lo que podría promover la eficiencia catalítica. Todos estos usos potenciales han impulsado una gran cantidad de investigación sobre polímeros de coordinación en los últimos años (así como “marcos metal-orgánicos” relacionados).
Ahora bien, ¿pueden todos los enlaces a lo largo de esta cadena de metal-ligando realmente mantenerse unidos para formar un polímero? Una diferencia clave entre los enlaces covalentes que ha visto en los polímeros orgánicos y los enlaces dativos aquí es que los enlaces dativos son reversibles. Siempre hay un equilibrio entre el complejo metal-ligando y el metal libre y ligando. Por supuesto, este enlace podría ser muy fuerte, en cuyo caso el equilibrio se encuentra hacia el complejo metal-ligando. En otras palabras, una gran fracción del material formaría el complejo metal-ligando. ¿Qué tan grande es una fracción? El valor real no es tan importante en estos momentos. Para nuestros propósitos, digamos que juntamos un metal y un ligando y el 90% de las moléculas forman un complejo. Y supongamos que eso también es cierto en el siguiente paso, traer otro ligando a la imagen para unirse al metal, y en el paso posterior, traer otro metal para unirse al otro extremo de uno de los ligandos, y así sucesivamente. Entonces, supongamos que cada uno de estos eventos conduce a una formación de 90% de producto.

El solo hecho de llegar a esa cadena de cuatro unidades se basa en tres equilibrios diferentes. Si, como decimos, cada paso procede alrededor del 90% del camino (lo que suena bastante bien; estarías satisfecho con un rendimiento del 90% en una reacción en el laboratorio), entonces todo el proceso de tres pasos produciría 0.90 x 0.90 x 0.90 = 0.73, o 73% producto. No está mal. Pero las cadenas poliméricas útiles podrían tener mil unidades de largo o más, en cuyo caso la cantidad de polímero realmente formada de la longitud de cadena apropiada sería de aproximadamente (0.90) 999 = 1.94 x 10 -46 o 1.94 x 10 -44%, y esa es una cantidad ridículamente pequeña.
Ahora bien, un cálculo real de la concentración de equilibrio es por supuesto más sofisticado que eso, pero este ejercicio rápido subraya un punto importante: para formar un polímero de coordinación estable de una longitud apreciable, el metal debe unir el ligando muy fuertemente. Por esa razón, muchos enfoques para los polímeros de coordinación han empleado [1]ligandos multidentados, que por supuesto se unen más estrechamente que los ligandos monodentados. Por ejemplo, el polímero formado usando la unión bidentado que se muestra a continuación sería mucho más estable con respecto a la despolimerización (es decir, se desmoronará nuevamente en monómeros) que el ejemplo monodentado mostrado anteriormente.