3.1: Termodinámica de Polimerización
- Page ID
- 72048
KP1. Termodinámica de Polimerización
La polimerización es el proceso de tomar monómeros individuales y encauzarlos en una macromolécula. Termodinámicamente, siempre hay dos factores a considerar en una reacción: las contribuciones entálpicas y las contribuciones entrópicas.
ΔG = ΔH - TΔS
Los cambios entrópicos en las polimerizaciones de cadena tienden a ser cualitativamente similares en diferentes casos. Debido a que una gran cantidad de monómeros están siendo enlazados juntos en una macromolécula, el número de grados de libertad siempre disminuye, independientemente del proceso de polimerización específico que se esté considerando. En consecuencia, el cambio de entropía asociado a la polimerización es siempre negativo.
ΔS = k B ln (W f/W i)
en la que k B es la constante de Boltzmann y W es el número de microestados disponibles en el estado final o inicial. Si W f < W i, entonces ΔS < 0 porque el logaritmo natural de una fracción es un número negativo.
La energía libre se correlaciona positivamente con la entalpía y negativamente con la entropía. Eso significa que un cambio negativo de entropía se traduce en un cambio positivo, y desfavorable, de energía libre. La polimerización siempre se ve desfavorecida entrópicamente, independientemente de las circunstancias. Sin embargo, debido a que los cambios de entropía son generalmente bastante pequeños en comparación con los cambios de entalpía, la polimerización procede a pesar de esta desventaja. El factor de entropía comienza a dominar la ecuación sólo a temperaturas más altas, debido a que la contribución de la entropía escala con la temperatura (en Kelvin) en la expresión de energía libre.
Como resultado, termodinámicamente, las polimerizaciones en cadena deben realizarse en condiciones más frías para maximizar el grado de polimerización. Sin embargo, existen ciertas polimerizaciones (como la polimerización por apertura de anillo de ésteres cíclicos) que frecuentemente se realizan a temperaturas elevadas debido a una barrera significativa a la reacción. Por supuesto, en estos casos tiende a haber un grado máximo de polimerización antes de que el proceso finalice en un equilibrio entre polímero y monómero.
En general, este problema entrópico en la entropía da lugar al término “temperatura techo”, que es la temperatura por encima de la cual no ocurrirá la polimerización de un monómero en particular.
En las polimerizaciones por condensación, la entropía de reacción es más sutil. La formación de productos secundarios de condensación, como el agua o el metanol, significa que no hay cambios globales en el número de moléculas antes y después de la polimerización. Por ejemplo, n co-monómeros se convierten en 1 cadena de polímero y n -1 moléculas de agua. Todavía puede haber cambios de entropía en la reacción, pero el signo del cambio de entropía no es tan fácil de predecir en comparación con la polimerización en cadena.
Dado que la entropía para las polimerizaciones en cadena siempre es positiva, entonces todas las polimerizaciones de cadena deben ser exotérmicas, porque de lo contrario nunca procederían. Las razones de estas reacciones entálpicamente favorecidas varían de un caso a otro.
En la polimerización de olefinas (polimerización de alquenos), la entalpía de reacción se ha medido en un amplio rango de casos; generalmente es de alrededor de -20 kcal/mol. Este valor ΔH negativo puede atribuirse en parte al intercambio de un enlace C=C π por un enlace C-C σ por cada monómero de alqueno encadenado. La resistencia de un doble enlace C=C promedio es de aproximadamente 147 kcal/mol, mientras que la resistencia de un enlace C-C promedio es de aproximadamente 83 kcal/mol. Por diferencia, la fuerza de un enlace C=C π es de aproximadamente 64 kcal/mol. Así, cuesta 64 kcal/mol romper el enlace π pero bajamos 83 kcal/mol por cada enlace σ hecho, para una disminución neta de alrededor de 20 kcal/mol.
| Bond | Energía de enlace (kcal/mol) | Bond | Energía de enlace (kcal/mol) | Bond | Energía de enlace (kcal/mol) |
| C-C | 83 | C-N | 73 | C=C | 147 |
| C-O | 86 | C-Cl | 81 | C=O | 178 |
| N-H | 93 | Cl-H | 102 | O-H | 111 |
Sin duda, hay otros factores que contribuyen al cambio de entalpía. Las fuerzas de enlace C-H cambian significativamente con los cambios de hibridación. Las interacciones estéricas intramoleculares son drásticamente diferentes en los monómeros estándar en comparación con los polímeros. En la polimerización de alquenos en particular, los cambios de fase entre el material de partida en fase gaseosa o líquida y el producto sólido son apreciables, aunque todavía son pequeños en comparación con los problemas de resistencia de la unión. Sin embargo, a primera vista esperaríamos una reacción moderadamente exotérmica, y eso es lo que se ha medido experimentalmente.
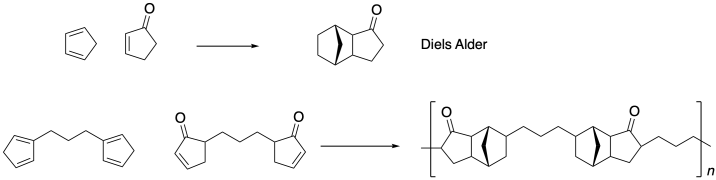
Problema KP1.1.
La polimerización de Diels Alder depende de una cicloadición [4+2]. Los estudios termodinámicos sobre la reacción parental indican ΔH = -40 kcal/mol. Explique esta observación en términos de fuerzas de unión.
Tomando un segundo ejemplo, la polimerización por apertura de anillo de ésteres cíclicos se considera exotérmica debido a la tensión del anillo. Los valores de ΔH dependen fuertemente del tamaño del anillo, que está íntimamente conectado con la tensión del anillo. Para γ-butirolactona, un anillo de cinco miembros que contiene un carbonilo, ΔH = -1 kcal/mol; eso no es suficiente para compensar una entropía negativa de reacción, de modo que este monómero solo se puede polimerizar a bajas temperaturas. Por otro lado, para δ-valerolactona, ΔH = -3 kcal/mol, mientras que para ε-caprolactona, ΔH = -7 kcal/mol. Estas lactonas de seis y siete miembros se polimerizan mucho más fácilmente debido al aumento de la tensión del anillo.
Problema KP1.2.
La temperatura del techo se puede calcular a partir de una suposición de que ΔG = 0, momento en el que la polimerización es fácilmente reversible. Un enfoque cinético del equilibrio da la relación:
T c = ΔH/(ΔS + R log [M])
en la que R es la constante de gas ideal, 1.98 cal K -1 mol -1 (o 8.314 J K -1 mol -1)
Calcular la temperatura límite para la polimerización de caprolactona si ΔH = -7 kcal mol -1 y ΔS = -8.6 cal K -1 mol -1 mol -1. La concentración de caprolactona pura es 8.7 M.
(Datos de: Olsen, P.; Odelius, K.; Albertsson, A.-C. Biomacromoléculas 2016, 17, 699-719.)
Dado un sesgo entrópico menos pronunciado contra la polimerización por condensación, la endotermicidad se vuelve menos crucial. En efecto, algunas polimerizaciones por condensación se efectúan a través de simples transesterificaciones, las cuales deben ser cercanas a la termoneutral. Como se señaló en la sección de condensación, estas reacciones son frecuentemente conducidas a su finalización por la eliminación del producto secundario de condensación, moléculas pequeñas como metanol o agua.
Problema KP1.3.
Algunas poliamidas se elaboran industrialmente a partir de las correspondientes aminas difuncionales y cloruros de ácido, liberando HCl. Calcular el cambio de entalpía para esta reacción.

