3.2: Cinética de la polimerización por crecimiento escalonado
- Page ID
- 72034
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)KP2. Cinética de la polimerización por crecimiento escalonado
Es importante entender cómo proceden las reacciones a lo largo del tiempo. Esta información nos puede indicar cuánto tiempo tardará un polímero en alcanzar una longitud óptima. También puede proporcionar información sobre cómo ocurre la polimerización, así como la cinética puede proporcionar información sobre otros mecanismos de reacción.
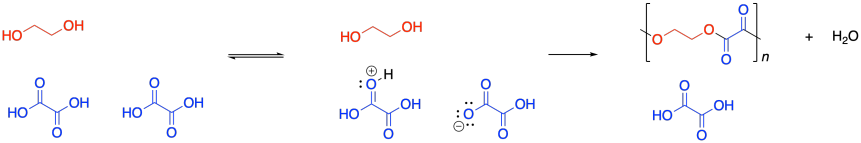
Los polímeros de condensación crecen a través de un proceso de crecimiento escalonado. La reacción generalmente implica la sustitución en un carboxiloide. Por ejemplo, la formación de poliéster a menudo implica la sustitución de un grupo funcional alcohol en un ácido carboxílico, haciendo un éster. El dibujo a continuación ilustra esa acción usando etilenglicol y ácido oxálico, para usar nombres comunes prevalentes en la industria. El ácido oxálico no se usa típicamente en la fabricación de poliésteres, pero se dibuja aquí como una estructura de ejemplo muy simple.
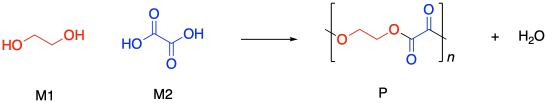
Si conoces alguna cinética básica, sabes que podemos expresar la velocidad de una reacción como la velocidad de cambio de la concentración del producto por cambio en el tiempo. En este caso, el producto es el polímero, abreviado P. Alternativamente, podríamos expresar la velocidad de la reacción como la velocidad de cambio de la concentración de monómero por cambio en el tiempo. Con solo mirar la ecuación de reacción, esperamos que cada vez que se hace una molécula de polímero, se agote una molécula de monómero. En este caso, tenemos un copolímero, hecho de dos monómeros diferentes, por lo que podríamos expresar la velocidad de reacción como la velocidad de cambio de cualquiera de las concentraciones de monómero. El signo negativo en la tasa sugiere que estamos viendo la tasa de desaparición del monómero; a medida que aparece el polímero, el monómero desaparece.
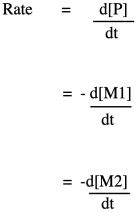
Si sabes algo sobre los mecanismos de reacción orgánica, quizás sepas que el primer paso en una esterificación es la donación de un par solitario de un alcohol oxígeno en el diol a un carbono carbonilo en el ácido dicarboxílico. (En realidad podría ser el segundo paso, pero llegaremos a eso más adelante.) Ese primer paso en el mecanismo es una reacción elemental. Todos los demás pasos que dibujarías en un mecanismo son también reacciones elementales. Lo bueno de las reacciones elementales es que siempre conocemos la ley de tasas de cada una: es una constante de velocidad multiplicada por las concentraciones de todas las especies que conducen a ese paso. En este caso, este primer paso es también el paso determinante de la velocidad, por lo que toda la reacción se rige por la ley de velocidad de ese primer paso. Requiere de ambos monómeros, por lo que obtenemos una ley de tarifas simple.
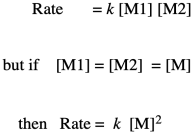
Nótese que, con base en la estequiometría (la relación de monómeros en la ecuación de reacción), probablemente realizaríamos esta polimerización con cantidades iguales de diol y ácido dicarboxílico. En lugar de preocuparnos por M1 y M2 por separado, podemos llamarlos a ambos [M].
Entonces, lo que tenemos aquí es una simple ley de tipo de segundo orden. Esta forma de la ley tarifaria se denomina ley de tasa diferencial, porque se expresa en términos de la tasa de cambio de una cosa con la tasa de cambio de la otra. Si eso no es exactamente lo que te interesa, y solo quieres ver qué pasa con las concentraciones a lo largo del tiempo, tal vez quieras integrar esta expresión para obtener el integrado de la ley de tarifas.
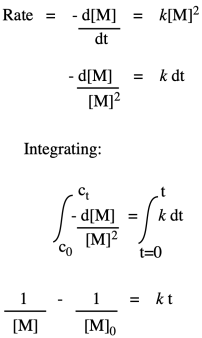
Si mediéramos la concentración de monómero periódicamente durante la polimerización y graficáramos su inversa a lo largo del tiempo, obtendríamos una línea recta. La pendiente de la línea sería la constante de velocidad, y la intercepción reflejaría la inversa de la concentración de monómero con la que habíamos iniciado la reacción.
En este punto, necesitamos hacer una pausa y hablar sobre lo que realmente queremos decir con concentración de monómero. Debido a una característica muy específica de las polimerizaciones por condensación, no es realmente la concentración de etilenglicol o ácido oxálico. Echa un vistazo a este dibujo de este proceso de crecimiento paso a paso y hablaremos de por qué es así.
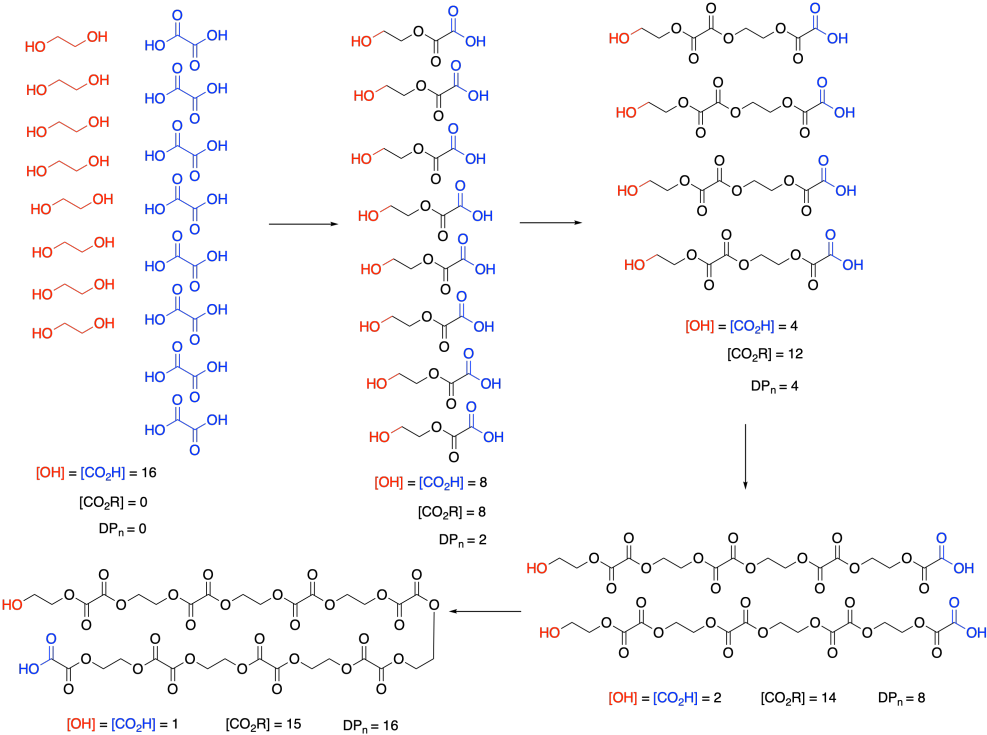
Recuerde que, en la polimerización de crecimiento escalonado, la mayoría de las moléculas probablemente están reaccionando a tasas más o menos similares. Dos monómeros se unen para formar dímeros, dos dímeros forman tetrámeros, dos tetrámeros forman octámeros, y así sucesivamente. No va a ir tan perfectamente como vemos en esta imagen; inevitablemente habrá algunos rezagados que echan fuera los promedios. Pero fíjense lo que esto significa: los monómeros desaparecen enseguida. A nadie le interesa realmente la rapidez con la que los monómeros se convierten en dímeros. Quieren saber cómo está progresando la gótica de la cadena polimérica.
Entonces, en la expresión anterior, [M] no se refiere en absoluto a las concentraciones de esos dos monómeros. Se refiere a la concentración de los grupos funcionales reactivos en esos monómeros. Después de todo, una vez que los monómeros se han ido, la misma reacción de esterificación sigue ocurriendo, y realmente es la concentración de grupos alcohol y ácido carboxílico lo que importa, ya sea que se encuentren en monómeros, dímeros, tertrámeros, o lo que sea. En estas expresiones de tasa, a veces las personas usarán explícitamente [OH] y [CO 2 H] en la expresión de la tasa, subrayando que realmente están siguiendo la desaparición de esos grupos funcionales.
Y fíjense lo que les está pasando a esos grupos funcionales. Su concentración está bajando suavemente con el tiempo. Además, la concentración de éster, que representa el nuevo grupo funcional en el polímero, está creciendo a la misma velocidad. [OH] y [CO 2 H] caen 8 (o a la mitad) en el primer paso; [CO 2 R] aumenta en 8, y así sucesivamente. Por lo tanto, la tasa de consumo de grupos funcionales reactivos es igual a la tasa de aparición de los grupos funcionales del producto.
La otra cosa que nos interesa aquí es el grado de polimerización: el número de monómeros incorporados a la cadena. El polímero está creciendo a cierto ritmo, pero ¿cuánto tiempo está llegando? Con solo observar el esquema simple de crecimiento de polímeros anterior, vemos que el grado promedio de polimerización aumenta (escrito como DP o a veces como X n; una barra sobre el símbolo señala que estamos viendo un promedio). Si miras cuidadosamente, verás que el grado de polimerización es siempre la concentración de monómero original dividida por la concentración de monómero restante. Esa resulta ser una relación muy importante.

Obsérvese que esta relación es solo la inversa de la fracción de monómero restante (o, realmente, la fracción de esos grupos funcionales monoméricos sobrantes).
![]()
La cantidad opuesta es la fracción de monómero convertido. Eso describe los grupos funcionales ya convertidos en ésteres. Debido a que estamos tratando con fracciones, la fracción convertida es solo una menos la fracción restante. Si hacemos un poco de álgebra, obtenemos una variación de esa información.

¿Por qué hicimos esa última parte? Porque ahora hemos vuelto a la expresión para el grado de polimerización. Entonces, ahora tenemos una forma equivalente de expresar grado de polimerización en términos de la fracción convertida. Esta relación se llama la ecuación de Carothers, en honor a Wallace Carothers, el químico de DuPont que inventó el nylon.
Problema KP2.1.
Predecir el grado de polimerización si 75% de los grupos finales monoméricos se han convertido en polímero.
Entonces, ¿cómo es esa relación? Aquí hay algunos datos de Paul Flory, otro químico de DuPont y premio Nobel, obtenidos durante el periodo entre las Guerras Mundiales cuando este tipo de química recién comenzaba (Flory, P. J. J. Am. Chem. Soc. 1937, 59, 466-470).
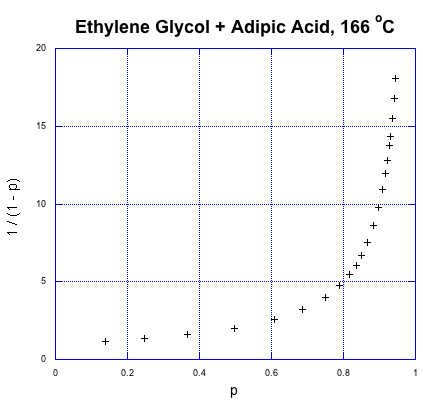
Esa es la fracción convertida en el eje x y la expresión para el grado de polimerización en el eje y. Esto es crecimiento exponencial. El grado de polimerización está empezando a dispararse dramáticamente hacia arriba. Ya lo sabíamos desde nuestra introducción al crecimiento escalonado, pero lo que destaca de los datos es cómo un mayor grado de polimerización, y alto peso molecular, realmente no ocurre hasta muy tarde en la reacción. Si necesitamos polímeros de condensación de alto peso molecular, es mejor que la química sea bastante confiable; de lo contrario, si las cosas salen mal, nos quedaremos con algo de sustancia goo de cadena corta en lugar de materiales de cadena larga.
Ahora tomemos estas nuevas relaciones y las veamos en el contexto de nuestra cinética de segundo orden. Estamos comenzando con esa misma ley de tasa integrada, pero hemos multiplicado todo en ambos lados de la ecuación por la concentración de monómero inicial. Eso es juego limpio en álgebra, recuerden. La razón para hacerlo es conseguir un término que se asemeje a nuestras relaciones que describan el grado de polimerización.
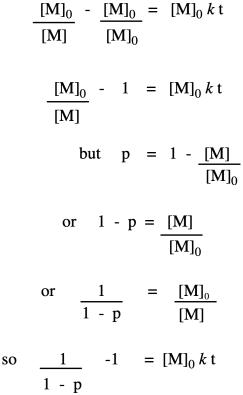
Hasta el momento, hemos tomado la relación que obtuvimos en la primera línea y elaboramos su relación con la fracción convertida, que sustituimos en la última línea. Ahora traemos la ecuación de Carothers para recordar que esto realmente nos está diciendo cómo cambia el grado de polimerización con el tiempo. Esta relación indica que el grado de polimerización debe aumentar linealmente con el tiempo.
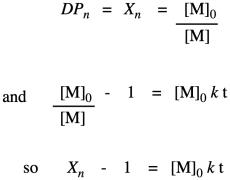
Esta relación indica que el grado de polimerización debe aumentar linealmente con el tiempo. Una vez más, vamos a utilizar los datos de Flory para ilustrar la relación, utilizando los datos de conversión de fracciones. Podía medir esos datos fácilmente, y sabía cómo se relacionaban con el grado de polimerización.
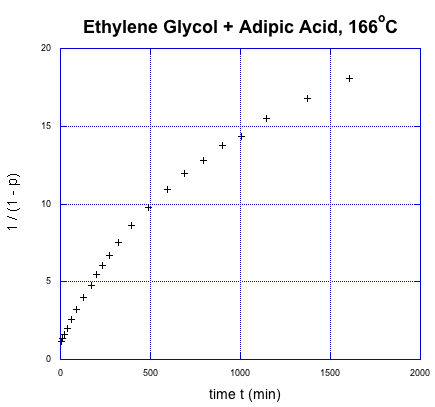
Se suponía que era lineal. Pero no te preocupes; Flory sabía lo que salió mal. Quizás también sepas si recuerdas algunas cosas sobre la sustitución en los carboxloides. El problema es que estamos tratando con un nucleófilo neutro y un electrófilo bastante poco reactivo. Esa reacción debería ser muy lenta. No es tan lento, aunque, porque es autocatalizado. Un monómero de ácido carboxílico puede activar otro, convirtiéndolo en un mejor electrófilo.
Eso significa que el acoplamiento del alcohol con el ácido carboxílico no es el primer paso elemental de la reacción, sino el segundo. Antes de que el alcohol y el ácido carboxílico puedan unirse, dos ácidos carboxílicos necesitan haber colisionado ya. Eso significa que tenemos una reacción de tercer orden. Como sucede, la forma integrada de una ley de tasas de tercer orden no es tanto más complicada, y podemos hacer algo de álgebra similar con ella para ver cómo variaría el grado de polimerización con el tiempo dada esta nueva información.
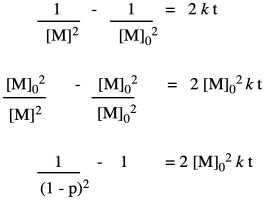
Podemos volver a tomar los datos de Flory y darle este nuevo tratamiento.
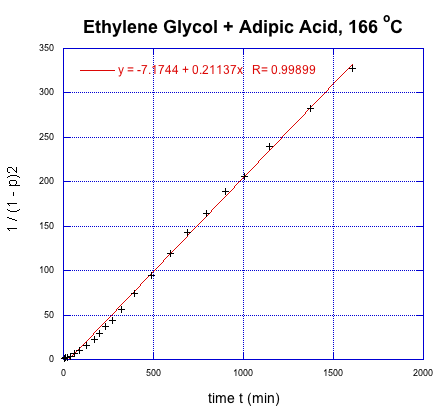
Esta vez, obtenemos una relación lineal. Esa corrección ilustra uno de los usos fundamentales de la cinética, que es una herramienta que nos permite sondear cómo ocurren las reacciones. En este caso muy específico, la cinética mostró que hubo un paso extra (pre-determinación de la velocidad) en la reacción. Además, encontramos que es el cuadrado del grado de polimerización el que va aumentando linealmente con el tiempo.
Problema KP2.2.
Dada una concentración inicial del grupo alcohólico [M] 0 = 17 M, determinar la constante de velocidad a partir de los datos de Flory en L 2 mol -2 s -1.
Flory también estableció una base estadística para predecir pesos moleculares y distribuciones de peso molecular en polímeros. Por ejemplo, una vez que tenemos el grado de polimerización, es un paso sencillo para calcular el peso molecular aproximado. Eso es solo el grado de polimerización multiplicado por el peso molecular del monómero; en otras palabras, el número de monómeros en la cadena multiplicado por el peso de cada uno. (Este enfoque descuida cualquier molécula pequeña como el agua que se pierde durante la reacción de condensación).
M n = DP x M 0
M n = M 0/(1 - p)
A esto se le llama el peso molecular promedio numérico. Se basa en tomar un valor promedio para la longitud de la cadena y convertirlo en el peso molecular de la cadena. Por supuesto, algunas cadenas pueden ser mucho más cortas (Flory en realidad muestra, con base en la probabilidad, que sobrarán varios monómeros) y como tales contribuyen menos a la muestra general.
Una segunda forma de abordar el peso molecular promedio de la cadena es evaluar la fracción del peso total aportada por cada longitud de cadena. El peso molecular promedio de la cadena estaría dado entonces por:
M w = σ π x xM 0
en el que π x es la fracción de cadenas de longitud x.
¿Cuál es la fracción de cadenas de longitud x? El enfoque comienza considerando la probabilidad de que una cadena tenga x unidades de longitud. Como se señaló anteriormente, una cadena x unidades de longitud tiene enlaces éster x-1 y 2 extremos de cadena sin reaccionar. Sabemos que la probabilidad de que un extremo de cadena se convierta en un enlace polimérico es p, y en una cadena x unidades de largo eso tendrá que suceder x-1 veces, para una probabilidad p x-1. También sabemos que la probabilidad de que un grupo funcional quede sin reaccionar es 1-p, y eso tiene que suceder dos veces aquí, para una probabilidad (1-p) 2. La probabilidad de tener una cadena de longitud x es:
π x = x p x-1 (1-p) 2
Eso significa:
M w = σ x p x-1 (1-p) 2 xM 0
M w = (1-p) 2 M 0 σ x 2 p x-1
La serie de la derecha es reducible a:
σ x 2 p x-1 = (1 + p)/(1 - p) 3
Para que:
M w = (1-p) 2 M 0 (1 + p)/(1 - p) 3
M w = M 0 (1 + p)/(1 - p)
Eso proporciona una predicción directa del peso molecular promedio en peso basado en la fracción convertida en polimerización por condensación. Aunque Mn y Mw que aquí se presentan son predicciones esencialmente teóricas del peso molecular, estas cantidades también se pueden medir experimentalmente utilizando diferentes métodos.
La relación entre estas dos cantidades siempre se ha utilizado como expresión de la amplitud de la distribución del peso molecular, llamado índice de polidispersidad o simplemente la dispersidad:
D = M w /M n
En el caso de la polimerización por condensación,
D = [M 0 (1 + p)/(1 - p)]/[M 0/(1 - p)]
D = 1 + p
Debido a que p es siempre una fracción, el resultado es que se espera estadísticamente que la dispersidad de una polimerización por condensación sea menor a 2.0.
Problema KP2.3.
Dada la conversión del 99% de monómeros con peso molecular promedio 120 g/mol, se calcula M w, M n y D.

