3.4: Cinética de la polimerización catalítica
- Page ID
- 72035
KP4. Cinética de la polimerización catalítica
La polimerización Ziegler-Natta de alquenos se realiza bajo condiciones catalíticas. En la mayoría de los casos, el proceso implica catálisis heterogénea, en la que la reacción tiene lugar sobre la superficie de un sólido. La cinética de las reacciones catalizadas tiene algunas características que son diferentes de otras reacciones y que vale la pena explorar.
El hecho de que la reacción se esté llevando a cabo sobre la superficie de un sólido es una característica clave que debe destacarse en la cinética de catálisis heterogénea. El tratamiento de las tasas, por lo tanto, utiliza un enfoque desarrollado por Irving Langmuir, un científico de larga data de General Electric que fue galardonado con el Premio Nobel por el estudio de superficies. Una de las cosas que hace que los catalizadores metálicos sean tan útiles es su capacidad para adsorber moléculas en sus superficies (piense en los metales preciosos utilizados en la hidrogenación catalítica, adsorbiendo alquenos e hidrógeno; o el hierro en la síntesis de Haber-Bosch de amoníaco, adsorbiendo dinitrógeno e hidrógeno, por citar dos importantes ejemplos). “Adsorción” se refiere a la adhesión de moléculas a una superficie. Langmuir pensó en este proceso de adsorción como dinámico, con moléculas aterrizando y pegándose a puntos abiertos en una superficie incluso cuando otras moléculas se levantaron para crear vacantes.

La desorción, por otro lado, se refiere al proceso de las moléculas que salen de la superficie.
En términos de cinética, la tasa de desorción de una molécula dependería de alguna constante de velocidad, k d, y la fracción de la superficie cubierta por estas moléculas, θ (esa es la letra griega, theta). Cuanto mayor sea la fracción superficial cubierta por las moléculas, mayor será la probabilidad de que encuentre una desorción.
Tasa d = k d θ
Por otro lado, la velocidad de adsorción de una molécula sobre una superficie dependerá de alguna constante de velocidad k a, la concentración de la molécula a adsorber y la fracción de la superficie aún disponible. Esa última parte es 1 - θ, porque la fracción cubierta más la fracción descubierta equivaldría al conjunto. Tenga en cuenta que Langmuir estaba interesado en moléculas en fase gaseosa que se adsorbieran sobre una superficie, por lo que expresó las cosas en términos de presión más que concentración.
Tasa a = k a (1 - θ) [M]
En equilibrio, estas dos tasas se igualarán entre sí:
k d θ = k a [M] - k a θ [M]
θ (k d + k a [M]) = k a [M]
θ = k a [M]/(k d + k a [M])
Ahora tenemos una expresión para la fracción de la superficie cubierta por el sustrato. Este término se llama la “isoterma de Langmuir” y aparece en diversos fenómenos superficiales y catalíticos. Por lo general, se expresa de manera ligeramente diferente, en términos de una constante de equilibrio para la adsorción:

La velocidad de una reacción catalizada en esa superficie dependerá de la concentración del catalizador así como de una constante de velocidad para el encadenamiento, k prop o simplemente k p, y la cantidad de superficie cubierta por monómero (el monómero no unido no experimentará propagación). Un factor adicional, x*, toma en cuenta el hecho de que solo una fracción del catalizador está activa.

Superficialmente, la forma de la ley tarifaria tiene algo en común con la ecuación de Michaelis-Menten, con la que quizás ya estés familiarizado. La ecuación de Michaelis-Menten relaciona la velocidad de una reacción catalizada por enzimas con la concentración enzimática, la constante de velocidad para la reacción catalítica y las constantes de velocidad para la unión reversible del sustrato con la enzima.

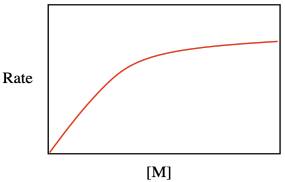
A lo mejor ese parecido no debería ser demasiado sorprendente. Después de todo, ambas ecuaciones describen procesos catalíticos, en los que tanto la superficie como el sitio de unión deben alojar el sustrato para llevar a cabo una serie posterior de reacciones. Ambas ecuaciones toman la forma de una curva de saturación, lo que indica que la velocidad de reacción se nivelará si la superficie o el sitio de unión quedan completamente ocupados.
Problema KP4.1.
Una forma de evaluar las relaciones multitérmino es considerar lo que sucede bajo diferentes condiciones. ¿Qué sucede con la ley de velocidad para la polimerización catalítica si la concentración de monómero es muy baja, de manera que 1 >> K eq [M]?
Problema KP4.2.
¿Qué sucede con la ley de velocidad para la polimerización catalítica si la concentración de monómero es muy alta, de manera que K eq [M] >> 1?

