3.3: Cinética de la polimerización en cadena
- Page ID
- 72049
KP3. Cinética de la polimerización en cadena
La polimerización de alquenos ocurre de una manera muy diferente a los monómeros que experimentan reacciones de condensación. Ya sea que ocurra a través de un mecanismo aniónico, catiónico o radical, la polimerización de alquenos implica una reacción en cadena. Las reacciones en cadena se ilustran clásicamente por la química radical, por lo que analizaremos un tratamiento de la polimerización en cadena radical para ver algunos de los factores que influyen en las velocidades de polimerización.
Una polimerización radical típica comienza con la descomposición térmica de un iniciador de radicales para proporcionar dos radicales. La velocidad de descomposición depende únicamente de la constante de velocidad de descomposición y de la concentración del iniciador.
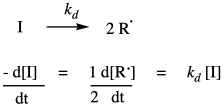
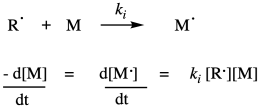
Una vez que los radicales han sido generados, son capaces de sufrir adición radical a un doble enlace monómero. Por supuesto, la adición radical a un doble enlace da como resultado un nuevo radical donde solía estar el doble enlace. Aunque se trata formalmente de una etapa de propagación de radicales, en la química de polímeros se le llama etapa de iniciación, porque es la primera vez que un monómero se somete a adición de radicales. Este paso consume el primer monómero y produce una nueva especie radical que se convertirá en la cadena radical creciente. Requiere una colisión entre el radical y un monómero, por lo que la velocidad de iniciación depende de esas dos concentraciones y de la constante de velocidad de iniciación de la cadena, k i.
Esa ley de tasa depende de un intermedio reactivo. No es una ley de tasas muy útil, porque el intermedio reactivo no es algo que hayamos medido y agregado directamente a la reacción, y puede que ni siquiera ocurra a niveles lo suficientemente altos como para poder medir su concentración a medida que avanza la reacción. Por lo general, buscamos formas de expresar la ley de tarifas de formas que no incluyan intermedios reactivos. En esta situación particular, la forma de sortear esta situación es asumir que la descomposición del iniciador es el paso determinante de la velocidad. Hacer los radicales en primer lugar es probablemente la parte lenta porque depende en gran medida de la ruptura de enlaces, que es intensiva en energía. Una vez que tenemos radical, probablemente sufra adición a un monómero con bastante rapidez, iniciando el crecimiento de la cadena. Si eso es cierto, podemos suponer que el paso de inicio de la cadena avanza muy rápidamente después, de manera que la tasa realmente depende solo de la velocidad del paso de descomposición.
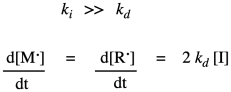
En la práctica, los químicos poliméricos agregan otro factor a la ley de tarifas. Este factor, f, toma en cuenta el hecho de que solo algunos de los radicales del iniciador reaccionan realmente con monómeros para iniciar cadenas en crecimiento. El resto se descompone a través de algunas otras reacciones secundarias. Por lo general, se supone que f es alrededor de 0.5.
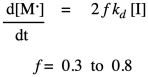
Una vez que el primer monómero se ha iniciado en un radical, puede reaccionar con otro monómero para encadenarlo y formar un nuevo radical. Esta es la etapa principal de propagación de la reacción en cadena. Ese paso seguirá repitiéndose, agregando más monómeros a la cadena. La constante de velocidad para este paso, k prop o k p, es idéntica sin importar cuántos monómeros se hayan encadenado, pero es distinta de k i debido a la naturaleza diferente de los intermedios radicales en las dos etapas diferentes. Por ejemplo, el radical obtenido de la adición al estireno se ve bastante similar ya sea el primero de la cadena o el décimo. Cada vez, la tasa de consumo de monómero depende de la constante de velocidad de propagación, la concentración del monómero y la concentración del radical propagador. Observe que en la ley de tarifas solo escribimos ese radical propagador de la misma manera (punto M) sin importar cuánto tiempo crezca la cadena.
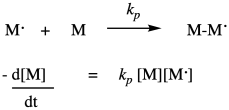
Hay un último proceso, o grupo de procesos, para completar el ciclo de reacción en cadena. En la terminación, dos radicales se combinan de alguna manera para formar productos de caparazón cerrado. Hay una variedad de formas que pueden ocurrir en una polimerización radical. El evento más simple conceptualmente es el acoplamiento, en el que dos cadenas radicales se unen y forman un vínculo. Esa idea se muestra a continuación.
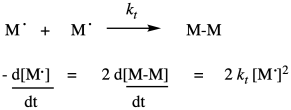
Por supuesto, esa tasa depende de la constante de la tasa de terminación y de las concentraciones de ambas cadenas de crecimiento. Lo mismo sería cierto si la reacción terminara por conproporcionación, en la que un radical abstrayera un hidrógeno alfa del otro, formando un producto saturado y uno insaturado.
Una vez más, estas dos últimas tasas —de propagación y de terminación— dependen de concentraciones de intermedios reactivos, que normalmente no conocemos. Esta vez usaremos una suposición muy estándar, que es que la concentración de esta especie reactiva permanece constante, siendo consumida en cuanto se genera. La forma habitual en que aplicamos la aproximación de estado estacionario es asumir un cambio cero en la concentración del intermedio reactivo. Eso quiere decir que la suma de todas las tasas para los procesos que generan el intermedio equivale a la suma de todas las tasas que consumen el intermedio. En la química de polímeros, tomamos un ligero atajo, y solo asumimos que la tasa de aparición del radical en primer lugar es igual a su tasa de desaparición. Ya tenemos expresiones para ambas tarifas.

Al reorganizar, podemos obtener una expresión para la concentración de extremo de cadena reactiva. Entonces podemos simplemente sustituir el resultado en nuestra expresión para la tasa de propagación:
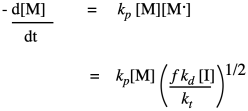
El resultado resume los factores que controlan la tasa de crecimiento del polímero. La tasa de crecimiento aumenta linealmente con la concentración de monómero, y como la raíz cuadrada de la concentración de iniciador. El resto de los factores son solo constantes, por lo que podemos pensar en la ley de tasas como una constante combinada y esas dos dependencias de concentración. A veces una constante agregada de este tipo se acaba de designar k'.
Obsérvese que la tasa de propagación varía linealmente con la concentración de las cadenas de cultivo, pero que la tasa de terminación varía con el cuadrado de la concentración de las cadenas de cultivo. Esa diferencia es significativa, y subyace a la estrategia de polimerización viva, que es mantener baja la concentración de cadenas en crecimiento. Hacerlo tiene el efecto adverso de ralentizar la velocidad de propagación, pero el efecto sobre la tasa de terminación es mucho mayor, lo que hace que este compromiso valga la pena para lograr un mayor control del peso molecular.
Problema KP3.1.
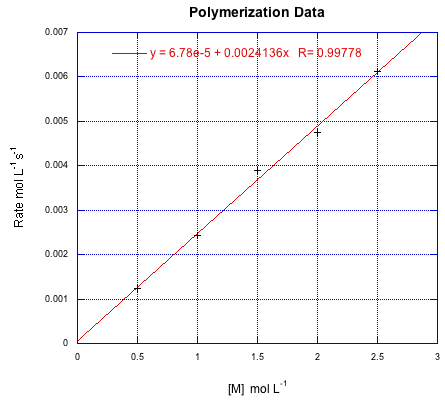
Supongamos que se obtuvieron los siguientes datos para una polimerización radical realizada a diversas concentraciones iniciales de monómero. Si todos los datos se realizaron a una concentración de iniciador de 0.25 mmol L -1, calcule k'.
La cinética también se puede usar para establecer una longitud teórica de cadena de polímero. Esta cantidad se denomina longitud de cadena cinética, representada por “barra vee”. En principio, es solo la relación entre la tasa de propagación de la cadena y la tasa de iniciación de la cadena. Eso debería decirnos el número de monómeros por cada cadena iniciada. Debido a nuestra suposición anterior de que la tasa de inicio es igual a la tasa de terminación, podemos subsituar los términos para esas dos tarifas y simplificar el resultado.

Sustituir nuestra expresión anterior por la concentración de los extremos de la cadena radical en crecimiento da una nueva expresión.
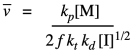
Eso significa que teóricamente podemos controlar la longitud de las cadenas poliméricas, ya que la longitud promedio debe variar linealmente con la concentración de monómero e inversamente con la raíz cuadrada de la concentración de iniciador.
Como reacciones en cadena, las polimerizaciones catiónicas y aniónicas tienen algunas características en común con las polimerizaciones por radicales. Una diferencia clave es que el iniciador no se fragmenta en dos trozos, cada uno capaz de iniciar una cadena; en cambio, un iniciador agregado inicia la polimerización de una cadena, sin la etapa de descomposiciones previa observada en las reacciones radicales. Además, las etapas de terminación en las reacciones radicales están dominadas por recombinaciones radicales (así como otras variaciones), pero en terminaciones aniónicas y catiónicas es más probable que la cadena en crecimiento encuentre una impureza y reaccione con eso.
Problema KP3.2.
Dado que para una polimerización catiónica:
Tasa init = k i [M] [I] y Término de tasa = k t [M +]
Proporcionar una expresión en estado estacionario para la concentración de cadena catiónica en crecimiento.
Problema KP3.3.
Si la etapa de propagación en una polimerización catiónica se escribe de la siguiente manera:
M + + M → M-M +
Proporcionar la expresión de velocidad para la polimerización catiónica.
Problema KP3.4.
Por analogía con la polimerización radical, la longitud de la cadena cinética en la polimerización catiónica se puede expresar como la relación entre la velocidad de propagación y la velocidad de iniciación. Proporcionar una expresión en términos de constantes y concentraciones conocidas.
Problema KP3.5.
En una polimerización viva, la longitud de la cadena se simplifica a [M] 0/[I] 0 porque toda iniciación conduce a la polimerización y no hay etapas de terminación. Dada una polimerización radical con [M] 0 = 4.5 M y [I] 0 = 1.25 mM, compare la longitud de la cadena en las siguientes situaciones:
a) una polimerización viva
b) una polimerización no viva con f = 0.5; k p = k t = 0.003 s -1; k d = 0.0001 s -1.
c) una polimerización no viva con f = 0.5; k p = 0.003 s -1; k t = 0.3 s -1; k d = 0.0001 s -1.
d) una polimerización no viva con f = 0.5; k p = 0.003 s -1; k t = 0.003 s -1; k d = 0.1 s -1.

