1.1: Grupo Carbonilo - Notación, Estructura y Enlace
- Page ID
- 74324
Introducción
La química orgánica es la química del elemento carbono. Los compuestos formados a partir del carbono y algunos otros elementos (O, N, P, S y H) forman la base química de los sistemas vivos. La mayoría de los fármacos terapéuticos son compuestos orgánicos. Los polímeros orgánicos, ya sean obtenidos de la naturaleza o por medios sintéticos, son materiales económicos extremadamente importantes. Estos incluyen plásticos, caucho, pegamentos, almidón, algodón y madera, así como las proteínas que debemos tener en nuestra dieta.
¿Por qué se llama química “orgánica”? Históricamente, cuando los químicos descubrieron la Ley de Proporciones Definidas a principios del siglo XIX, parecía que esta ley no se aplicaba a los diversos compuestos que habían aislado de fuentes vegetales y animales. Los compuestos de carbono pueden ser tan complejos que las proporciones de elementos en ellos no parecían ser números simples. Por ejemplo, el azúcar de mesa ordinario tiene la fórmula molecular C 12 H 22 O 11, no el tipo de relación simple que se ve con los óxidos de cobre, Cu 2 O o CuO, por ejemplo. Los químicos imaginaron que los compuestos orgánicos se mantenían unidos por una misteriosa “fuerza vital”.
El principio del fin de la hipótesis de la “fuerza vital” se considera generalmente como la síntesis de urea de Friedrich Wöhler en 1828. Empezó con cianato de plomo, que está casi tan “muerto” como puede ser cualquier químico, e hidróxido o cloruro amónico, también “muerto”, que generó cianato amónico, NH 4 + OCN - (fórmula empírica CH 4 N 2 O) (todavía “muerto”). Cuando calentó el cianato amónico, obtuvo urea, H 2 NCONH 2 (fórmula molecular también CH 4 N 2 O, pero los átomos dispuestos de manera diferente). La urea es justo como suena el nombre, un ingrediente importante en la orina, y en ese momento se pensaba que era un químico puramente “orgánico”. Otras síntesis de compuestos “orgánicos” a partir de materiales “inorgánicos” pronto convencieron a los químicos de que los compuestos orgánicos obedecían las mismas leyes de la química que otros químicos.
Si bien los químicos renunciaron a la hipótesis de la “fuerza vital” al menos hace 150 años, una sombra de ello persiste en la noción popular de que los materiales orgánicos “naturales” son de alguna manera más seguros o saludables que los químicos sintéticos. Esta noción popular ignora el hecho de que no sabríamos, por ejemplo, qué es la vitamina C si no pudiéramos averiguar su estructura molecular, sintetizarla y demostrar que el material sintético es en todos los sentidos idéntico a la vitamina C que el famoso químico húngaro Szent-Gyorgy (pronunciado “Saint-George”) primero aislado de pimientos húngaros. Este pedacito de cultura popular también ignora la toxicidad de la nicotina, la estricnina, la toxina del pez globo y la toxina del botulismo, el último de los cuales es el químico más venenoso conocido. Incluso se podría llamar al virus del SIDA un “químico orgánico”, ya que tiene una estructura química conocida, aunque su capacidad para reproducirse en el cuerpo humano (y sufrir una rápida evolución molecular para vencer la respuesta inmune o inhibidores químicos) lo hace mucho más siniestro que un mero veneno.
Aprenderá y aplicará los principios que rigen la estructura del compuesto orgánico y relacionará su comprensión de la estructura con las reacciones, los cambios en la estructura, que ocurren cuando porciones específicas de compuestos orgánicos interactúan con otras sustancias químicas. Pasaremos las primeras semanas del semestre analizando un grupo de compuestos orgánicos que comparten un elemento estructural común: el grupo carbonilo.
Principios Estructurales
Primero, sin embargo, necesitamos revisar algunas características estructurales del átomo de carbono. Estas son ideas que formaban parte de tus cursos generales de química, pero ayudará si las reafirmamos brevemente.
- El carbono es tetracovalente. Eso significa que un átomo de carbono normalmente hace cuatro enlaces con otros átomos y que estos enlaces son covalentes-formados al compartir un par de electrones entre los dos átomos unidos por el enlace. Tales arreglos proporcionan ocho electrones de valencia para un átomo de carbono, de manera que su configuración electrónica es como la del neón de gas noble muy estable. De manera similar, el hidrógeno forma un enlace covalente, el oxígeno dos y el nitrógeno tres.
- El carbono puede formar múltiples enlaces covalentes. Es decir, un solo átomo de carbono puede formar un enlace doble (a C, O o N) o triple (a C o N) a otro átomo. Un doble enlace implicaría dos pares de electrones entre los átomos unidos y un triple enlace implicaría tres pares de electrones.
- Los enlaces entre carbono y átomos distintos al carbono o hidrógeno son polares. Es decir, en un enlace entre carbono y oxígeno o nitrógeno los electrones están más cerca del elemento más electronegativo (oxígeno o nitrógeno) que al carbono, por lo que el carbono tiene una carga ligeramente positiva. (El flúor es el elemento más electronegativo, y los elementos cercanos al flúor en la tabla periódica también son bastante electronegativos).
- Los enlaces entre un átomo de carbono y otro y entre un carbono y un hidrógeno son no polares. Es decir, el par de electrones que forma el enlace es compartido de manera bastante uniforme por los átomos.
- Podemos predecir la geometría de los enlaces alrededor de un átomo usando la idea de que los pares de electrones y grupos de pares de electrones (como en enlaces dobles o triples) se repelen entre sí (Repulsión de pares de electrones de concha de valencia, teoría VSEPR—teoría).
Representando estructuras
Ahora, vamos a aplicar algunas de estas ideas a un pequeño compuesto orgánico, el formaldehído. La fórmula molecular (composición por elemento) del formaldehído es CH 2 O. Si interpretamos esto literalmente, leyendo de izquierda a derecha, obtenemos algo como esto (los enlaces se indican por líneas):
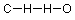
Si verificamos esto en contra de nuestra comprensión de cuántos enlaces debería formar cada átomo, encontramos que el carbono tiene un enlace donde esperamos cuatro, los hidrógenos tienen dos enlaces en lugar de uno, y el oxígeno tiene solo uno en lugar de los dos enlaces esperados.
Un mejor enfoque es dibujar cuatro enlaces al carbono y luego pensar cómo los hidrógenos y el oxígeno podrían estar vinculados al carbono. Si conectamos el carbono y el oxígeno por un enlace sencillo, obtenemos:
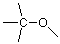
Aquí las líneas que no se conectan a más de un átomo representan valencias no utilizadas. Tenemos cuatro valencias sin usar y solo dos hidrógenos para usarlas, así que estaríamos atrapados con algo así como (hay otras posibilidades, pero ninguna basada en este esqueleto que funciona bien):
Si recordamos la posibilidad de que el carbono y el oxígeno puedan hacer un doble enlace, podemos echar un vistazo a un esqueleto como:
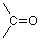
Ahora tenemos dos valencias sin usar y dos hidrógenos para conectarlas, así que al hacerlo llegamos a esta estructura para formaldehido.
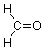
La unidad estructural compuesta por un carbono unido por un doble enlace al oxígeno se conoce como grupo carbonilo (a menudo representado como “C=O”). Pasaremos las próximas semanas en la química de este grupo ya que se encuentra en situaciones estructurales algo diferentes
Podemos aprender de este proceso que convertir una fórmula molecular en una estructura se realiza mejor trabajando primero los átomos que pueden formar más de un enlace, luego verificar cada esqueleto de prueba con los números típicos de enlaces para un átomo en particular. Aquellos que pasan esa prueba pueden ser probados aún más equilibrando el número de valencias no utilizadas contra los átomos restantes para que salgan parejos.
Más Carbones
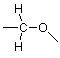
Veamos un caso más complejo, uno con varios átomos de carbono. Como aprenderás al estudiar la sección sobre isomería en Brown (Sección 3.2), una fórmula molecular no es suficiente para especificar la estructura de un compuesto orgánico que incluye más de tres carbonos. Necesitamos información sobre qué átomos, particularmente carbonos, nitrógenos y oxígenos, están conectados entre sí. Esto a menudo se representa en una fórmula condensada como:
Para dar una mirada más detallada a la estructura de este compuesto, necesitamos ampliar su representación. (Ver Brown, Sección 3.4) Como hemos aprendido a hacer, comenzamos por ignorar los hidrógenos y enfocarnos en los carbonos y el oxígeno para llegar a un esqueleto. Un esqueleto de prueba podría ser (donde las valencias no utilizadas se muestran nuevamente como líneas que se conectan a un solo átomo):
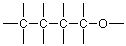
Si comparamos este esqueleto con la fórmula condensada anterior, el carbono del extremo izquierdo parece estar asociado con tres hidrógenos en la fórmula condensada y hay tres valencias no utilizadas en el carbono del extremo izquierdo como se muestra en el esqueleto, por lo que coincide bien. De manera similar, los dos carbonos medios tienen dos hidrógenos cada uno, y hay dos valencias no utilizadas en cada uno de esos carbonos en el esqueleto. Si coincidimos con todos estos arriba llegamos a:
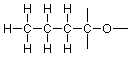
Sin embargo, el carbono del extremo derecho y el oxígeno son problemáticos. Solo nos queda un hidrógeno y hay tres valencias no utilizadas para tratar. Ya hemos visto esta situación antes cuando estábamos trabajando en formaldehído y podemos usar la misma idea aquí, para que probemos un doble enlace entre carbono y oxígeno. Eso nos da este esqueleto:
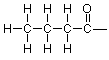
Añadiendo el hidrógeno final, llegamos a esta estructura expandida:
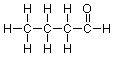
Estructuras de línea de unión
A menudo es inconveniente mostrar todos los carbonos e hidrógenos en detalle, sobre todo porque pronto aprenderemos que las partes de una molécula que están compuestas solo por carbono e hidrógenos unidos por enlaces simples no juegan un papel significativo en las reacciones de esa molécula. (Estas porciones de la molécula se conocen como “grupos R”). Podemos representar estos átomos y cómo están conectados mediante el uso de un tipo estructural abreviado conocido como estructura de línea de enlace. Tal estructura para el compuesto con el que acabamos de trabajar se muestra a continuación:
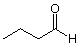
En una estructura de líneas de unión, los carbonos se muestran por los extremos “vacíos” de las líneas y por uniones (esquinas) entre líneas. Las letras al final de una línea representan átomos del heteroátomo designado (los heteroátomos son átomos distintos de carbono o hidrógeno. El hidrógeno a menudo se muestra cuando es necesario para mayor claridad.) Los enlaces dobles o triples están representados por dos o tres líneas paralelas que unen los mismos dos átomos. Los hidrógenos se agregan según sea necesario para llenar las valencias no utilizadas restantes.
Podemos “descomponer” el esqueleto de arriba rellenando primero los carbonos en las esquinas y los extremos “vacíos”:
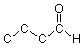
Luego contamos cuántos enlaces tiene mostrando cada carbono, y agregamos suficientes hidrógenos a cada carbono para llevar su número de enlaces hasta cuatro. (Para otros átomos como el oxígeno o el nitrógeno que pueden formar más de un enlace, se agregan hidrógenos según sea necesario para llegar a un número apropiado de enlaces). Por ejemplo, el carbono del extremo izquierdo tiene un enlace que muestra, por lo que necesitamos agregar tres hidrógenos:
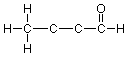
Continuando de la misma manera con los carbonos medios, cada uno de los cuales tiene dos enlaces mostrando, llegamos a la estructura expandida final:
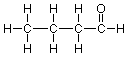
Observe que no necesitábamos hacer nada al carbono del extremo derecho (el carbono “carbonilo”) o al oxígeno, ya que estos átomos ya tienen el número apropiado de enlaces que muestran.
A veces representaremos una molécula mostrando sus grupos R de manera condensada y sus partes reactivas (grupos funcionales, ver siguiente conferencia) de una manera expandida:
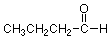
Todas estas representaciones son útiles, pero comúnmente usaremos la representación de stick o línea porque es económico dibujar. Debe practicar la conversión entre estructuras de barra o línea, estructuras condensadas, estructura expandida y las estructuras que muestran grupos R de manera condensada y grupos funcionales expandidos. Pruébalo con estos ejemplos:



