1.2: Grupos Funcionales, Hibridación, Nombramiento
- Page ID
- 74287
Representación Respuestas
Primero, veamos las diversas representaciones estructurales que se le pidió desarrollar para las moléculas dadas al final de la última conferencia. Aquí están:
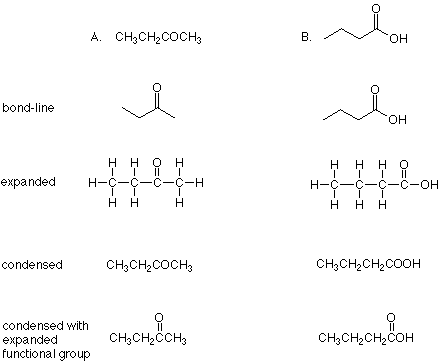
Compara tus respuestas con estas representaciones. Por favor, mírame si hay acertijos.
Nombramiento
Nombrar compuestos orgánicos es una necesidad, y los nombres de moléculas grandes pueden ser bastante complejos. Las reglas son simples, pero exigentes. Puedes aprender los conceptos básicos de estas reglas estudiando por tu cuenta utilizando las secciones correspondientes en Brown. Los principios se esbozan en la Sección 3.5. La aplicación de estas reglas a aldehídos y cetonas se discute en la Sección 11.2. Estudie estos, practique aplicarlos haciendo problemas y plantee acertijos en clase para discusión. Habrá preguntas de nomenclatura en los exámenes, por lo que se beneficiará trabajando en nombrar. Estas preguntas no abordarán ejemplos complejos.
Forma
Ahora veamos el grupo carbonilo para entender por qué es un sitio para la reactividad química. Comenzaremos examinando su geometría, específicamente los ángulos de enlace alrededor del átomo de carbono. Usaremos formaldehído como ejemplo:
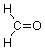
En el contexto de la teoría VSEPR notamos que hay tres grupos de electrones asociados a ese carbono, dos enlaces simples al hidrógeno y un doble enlace al oxígeno. La mejor manera de que estos grupos de carga negativa estén tan alejados entre sí para minimizar su repulsión mutua es adoptar ángulos de unión de aproximadamente 120 o:
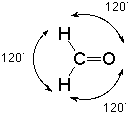
A tal arreglo se le da el nombre de "trigonal”.
El problema con esto es que si pensamos en los orbitales utilizados por los electrones de valencia de un átomo de carbono, son los orbitales 2s y 2p. Recordarás que los orbitales 2p están dispuestos en ángulos de 90 o entre sí.
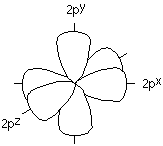
Esto no se ajusta a los ángulos de enlace de 120 o que necesitamos para nuestro grupo carbonilo.
Hibridación
Afortunadamente, la teoría de la mecánica cuántica nos dice que podemos mezclar los orbitales 2s y 2p en proporciones adecuadas sin violar las reglas matemáticas de las ecuaciones diferenciales. Si mezclamos el orbital 2s y dos de los orbitales 2p de esta manera, los orbitales resultantes se apuntan uno del otro. Los orbitales formados de esta manera se denominan orbitales híbridos y el proceso se llama hibridación. Estos orbitales híbridos particulares se denominan orbitales sp 2 ya que se hacen hibridando un orbital “s” y dos orbitales “p” y tienen la geometría apropiada para un átomo de carbono trigonal tal como se encuentra en el grupo carbonilo. (Véase la Sección 1.14 en Atkins y Carey para conocer las mismas ideas aplicadas a los carbonos doblemente unidos en etileno.)
Para resumir estas conexiones, cuando vemos un carbono involucrado en un doble enlace, su geometría será trigonal, con ángulos de enlace de 120 o, y tendrá hibridación sp 2. De manera taquigráfica trigonal y sp 2 son sinónimos.
Adhesión
Los orbitales híbridos sp 2 formados de esta manera forman enlaces simples. En el caso del formaldehído, cada enlace al hidrógeno se forma por solapamiento entre los orbitales híbridos sp 2 en el carbono carbonilo y los orbitales 1s en el hidrógeno. Esto forma lo que se llama orbital molecular, uno que involucra orbitales atómicos de dos o (menos comúnmente) más átomos. Cuando dos electrones, generalmente uno de cada átomo, ocupan este orbital molecular, tenemos un enlace covalente. Este enlace se conoce como un enlace sigma ya que tiene la forma de un cilindro (hot dog) y la letra sigma es la primera letra de la palabra griega para cilindro.
De manera similar, uno de los enlaces entre el carbono y el oxígeno se forma por solapamiento de un orbital híbrido sp 2 del carbono y un orbital similar del oxígeno. (El orbital de oxígeno también es un orbital híbrido sp 2, pero no lo perseguiremos). Este también es un enlace sigma. ¿Y el segundo enlace carbono-oxígeno?
Cuando discutimos el proceso de hibridación antes, es posible que se haya preguntado qué pasó con el orbital de carbono 2p que no se utilizó para formar el orbital híbrido sp 2. Todavía está ahí, y se utiliza para hacer el segundo enlace al oxígeno. Se solapa con un orbital 2p similar desde el átomo de oxígeno para formar lo que se llama un enlace pi. El término pi se usa porque la mitad de este enlace se extiende por encima del plano de los tres enlaces sigma y la mitad se extiende por debajo de ese plano. La primera letra de la palabra griega para avión es pi. El orbital molecular pi se puede visualizar como un bollo de hot dog, lo que nos llevaría a visualizar el doble enlace como un hot dog completo. Un enlace es un enlace sigma, representado por la salchicha, y el otro es un enlace pi, representado por el bollo.
Esta descripción de la unión en formaldehído se puede representar de esta manera (ver también la Figura 11.1 en Atkins y Carey):
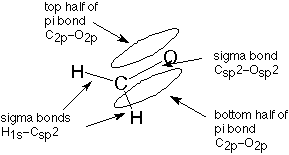
Representaciones similares se aplican a los carbonos de doble enlace en etileno (Atkins y Carey, Sección 1.14) y a los carbonos involucrados en un doble enlace dondequiera que se encuentren.
Sitios de reacción
¿Por qué este esquema de unión hace que el grupo carbonilo sea un grupo reactivo, un grupo funcional? Aquí hay tres cosas involucradas, al menos una de las cuales se ve en cada grupo funcional.
Primero, observe que el enlace pi está por encima y por debajo del plano de los enlaces sigma. Eso significa que los electrones en este enlace (los electrones pi) no están ubicados entre los núcleos de carbono y oxígeno cargados positivamente, sino que están por encima y por debajo de una línea que los une. Los electrones pi están más lejos de los núcleos y están menos fuertemente sujetos a ellos que los electrones sigma. Estos electrones pi son, en consecuencia, más fáciles de mover a una ubicación diferente que los electrones sigma. Si se mueven para hacer un nuevo enlace que involucra a otro átomo, el enlace pi se ha roto, la estructura ha cambiado y se ha producido una reacción. La declaración corta: los bonos pi son más fáciles de romper que los bonos sigma. Veremos varios ejemplos en las próximas conferencias.
Segundo, ambos enlaces carbono-oxígeno son polares (ver Atkins y Carey, Secciones 1.5 y 11.2). Eso significa que los electrones en ambos enlaces son más fuertemente atraídos por el átomo de oxígeno más electronegativo que por el carbono menos electronegativo. Esto da como resultado un oxígeno que está ligeramente cargado negativamente y un carbono que está ligeramente cargado positivamente. Un átomo que tiene un par de electrones para donar (una base de Lewis) será atraído por el carbono pobre en electrones y mostrará una tendencia a hacer allí un nuevo enlace. Un átomo que es deficiente en electrones (un ácido de Lewis) será atraído correspondientemente por el oxígeno rico en electrones y mostrará una tendencia a unirse allí. Podemos indicar esta polaridad usando el símbolo +—>, donde la flecha apunta hacia el extremo más negativo. También podemos usar la letra griega delta para describir una pequeña cantidad (mucho menor que el valor de un electrón) de carga:
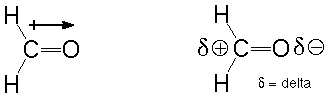
La declaración corta: los enlaces polares son lugares donde ocurren las reacciones.
Tercero, hay pares no compartidos de electrones (sitios estructurales de base de Lewis) en el oxígeno. Esto se puede ver si tomamos nuestra estructura expandida para formaldehído y la convertimos en una estructura de puntos de Lewis reemplazando cada línea con dos puntos para representar electrones:
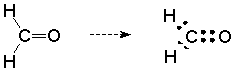
Esta imagen está incompleta. El oxígeno no tiene un octeto completo y no debe ser neutro en un sentido formal de carga. Podemos corregir esto mostrando los dos pares no compartidos en el átomo de oxígeno. Hacerlo representa el octeto completo y el oxígeno formalmente neutro, y lo más importante, nos dice que el oxígeno es una base de Lewis.
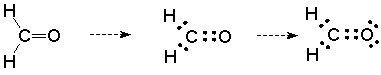
Entonces esperaremos que el oxígeno sea el sitio de reacción con los ácidos de Lewis. Esto refuerza la conclusión a la que llegamos sobre la base de la polaridad.
Por el contrario, considere que las partes del “grupo R” de las moléculas están hechas de carbonos e hidrógenos que están conectados por enlaces sigma. Los carbonos son sp 3 hibridados (Atkins y Carey, Sección 1.12) y no pueden formar enlaces pi. El carbono y el hidrógeno tienen una electronegatividad muy similar, por lo que el enlace sigma entre ellos no es para nada polar. Todos los electrones asociados con los átomos de carbono e hidrógeno están involucrados en la unión, y cada uno tiene una capa de valencia completamente ocupada. No hay pares no compartidos ni vacantes, por lo que ninguno de los átomos se comportará como un ácido o base de Lewis.
Para poner en práctica estas ideas, recorre los grupos funcionales enumerados dentro de la portada de Atkins y Carey (ignorar los alcanos). Cada grupo es reactivo por una o más de las razones enumeradas anteriormente. Enumere las razones de cada grupo y prepárese para discutir cualquier tema desconcertante en clase.


