1.3: Adiciones- Electrofílicas y Nucleofílicas
- Page ID
- 74260
Adición de Agua
La última vez enumeramos tres razones para esperar que el grupo carbonilo (C=O) sea un grupo funcional, una parte reactiva de la molécula. Todas estas razones estaban relacionadas con la forma en que los electrones se distribuyen en el grupo. Esto tiene sentido porque las reacciones implican hacer y romper vínculos. Los enlaces son electrones, por lo que hacer y romper enlaces cambiará la ubicación de los electrones. Los grupos funcionales son los lugares donde cambiar la ubicación de los electrones puede ocurrir con bastante facilidad, lo que significa que la distribución de electrones en un grupo funcional es clave para su reactividad.
Necesitamos un ejemplo específico para que estas ideas sean útiles. Comenzaremos con la adición de agua a un grupo carbonilo, específicamente al grupo aldehído carbonilo en acetaldehído. La reacción global (de los reactivos a los productos) es:
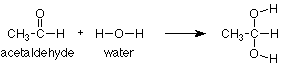
Este tipo de reacción se conoce como reacción de adición. El nombre encaja, porque el producto es la suma (o aducto) de los reactivos. Las reacciones de adición ocurren típicamente con grupos funcionales que incluyen enlaces pi. Los grupos funcionales que incluyen enlaces pi se denominan grupos funcionales insaturados porque algunos de los átomos en ellos tienen menos que el número máximo de enlaces sigma. Por el contrario, aquellos que no tienen enlaces pi sí tienen el número máximo (cuatro para carbono) de enlaces sigma y se denominan saturados. (Eche otro vistazo a la tabla de grupos funcionales dentro de la portada de Brown y observe cuáles son insaturados).
A medida que estudiamos más reacciones de adición de grupos funcionales insaturados durante el semestre, notaremos que el enlace pi en el reactivo está típicamente roto. En el producto encontramos que ahora hay dos grupos o átomos unidos donde había estado el enlace pi. En nuestro caso, el enlace pi entre el carbono y el oxígeno ha desaparecido y el hidrógeno del agua se ha agregado al oxígeno mientras que el grupo OH del agua se ha agregado al carbono.
También podemos notar que no le pasó nada al grupo CH 3. Está saturado por lo que carece de un enlace pi y no puede someterse a una reacción de adición. No es reactivo y simplemente se transporta desde el reactivo hasta el producto.
Coincidencia de polaridad
Profundicemos un poco más en esta reacción. ¿Tiene sentido que el grupo OH del agua se adhiera al carbono del carbonilo? ¿Tiene sentido que el H del agua se adhiera al oxígeno del carbonilo? Veamos la polaridad de estos materiales.
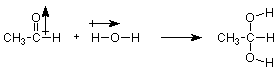
Observamos que el extremo positivo (carbono) del dipolo carbonilo se une al extremo negativo (oxígeno) del dipolo OH. Dicho de otra manera, el oxígeno rico en electrones del agua ataca al carbono pobre en electrones del grupo carbonilo. Gran parte de lo que aprenderemos en química orgánica puede estar relacionado con esta idea, y la desarrollaremos con más detalle más adelante en esta conferencia.
Nos dimos cuenta antes de que el grupo CH 3 no estuvo involucrado en ninguna ruptura de bonos o en la creación de bonos. En este sentido, es muy parecido al “ion espectador” que no hizo nada en una reacción inorgánica. Estos grupos se denominan “grupos R”. Dado que estos grupos no cambian en una reacción, debemos centrar nuestra atención en los grupos que sí, los grupos funcionales. Por ejemplo, predigamos cuál sería el producto de la siguiente reacción:
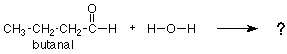
Podríamos recordar que el grupo carbonilo del acetaldehído (arriba) agrega agua, el grupo carbonilo similar del butanal (abajo) también debería hacerlo. Volveríamos a mirar la reacción del acetaldehído, notaríamos a dónde van el OH y el H, y pondríamos el OH y H en las mismas posiciones sobre el grupo carbonilo del butanal. Obtendríamos la siguiente respuesta:
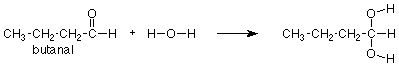
Reacción General
Observe nuevamente que el grupo CH 3 CH 2 CH 2 no cambió y simplemente se copia del reactivo al producto. Ayuda inmensamente pensar en esta reacción como una reacción del grupo carbonilo, no de todo el compuesto. De esa manera podemos centrar nuestra atención en la parte de la molécula que reacciona y considerar el resto como llevado para el paseo. Para expresar esto en símbolos, podemos escribir la siguiente ecuación que dice que la adición de agua es una reacción general del grupo carbonilo que se produce a cualquier aldehído.
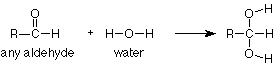
“" "R "” es un “" reemplazo "” para cualquier grupo que pueda estar unido a un aldehído carbonilo.” Si un caso específico nos dice que R = CH 3, entonces la ecuación completa es la primera que miramos (acetaldehído). Si alguna pregunta nos dice que R = CH 3 CH 2 CH 2, como lo hizo la pregunta butanal anterior, entonces podemos usar nuestra reacción general"R” (directamente arriba) y simplemente reemplazar “R” por CH 3 CH 2 CH 2 donde veamos “R.” Esto significa que en lugar de aprender cada reacción de cada compuesto, solo necesitamos aprender las reacciones de los grupos funcionales y cómo aplicarlas a casos específicos según sea necesario.
Mecanismo
Ahora que sabemos algo sobre cómo usar las reacciones generales (“R”) para abordar casos específicos, pasemos a otra pregunta. ¿Cómo se produce esta reacción? ¿Qué secuencia de eventos da como resultado la ruptura del enlace C-O pi y el enlace O-H en agua y la creación de un nuevo enlace C-O sigma y un nuevo enlace O-H sigma?
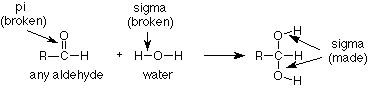
Algunas observaciones experimentales ayudarán. Encontramos que la adición de agua a un aldehído es bastante lenta si la solución es neutra (pH = 7, ni ácida ni básica), y que es mucho más rápida si se agrega ácido o base. De hecho, cuanto más ácido o base se agrega, más rápida va la reacción. El ácido o base no se agota, así que lo que estamos viendo es que el ácido o la base está actuando como catalizador.
Veamos primero el caso catalizado por ácido y preguntemos cómo un H + podría desempeñar un papel en esta reacción. ¿Dónde atacaría un H + al grupo carbonilo? A partir de nuestro análisis de la estructura C=O, esperaríamos que el H + pobre en electrones atacara electrones sobre el oxígeno rico en electrones del grupo C=O. Ya que necesitamos romper el enlace pi, hagamos que los electrones del enlace pi se muevan para hacer un nuevo enlace entre O y H.
Simbolizamos ese desplazamiento de electrones entre el carbono carbonilo y el oxígeno carbonilo dibujando una flecha curva que va desde la ubicación del enlace pi a la nueva ubicación de enlace entre el oxígeno carbonilo y el H +. Esa flecha puede interpretarse en el sentido de que el carbono pierde un electrón (la mitad de un par) y el hidrógeno gana un electrón. El oxígeno no gana ni pierde electrones ya que el par de electrones permanece conectado a él. El resultado de esta transacción es:
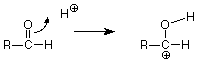
Manteniendo la puntuación, hemos roto el enlace carbono-oxígeno pi, y hemos hecho el nuevo enlace carbono-hidrógeno sigma. Todavía tenemos que hacer otro enlace, y el átomo de carbono cargado positivamente con solo tres enlaces parece un lugar reactivo. Necesitamos hacer un enlace entre ese carbono y el oxígeno del agua, pero ¿de dónde sacamos el par de electrones necesario para hacer ese enlace? El carbono es un candidato pobre, así que veamos el oxígeno. Cuando buscamos electrones para hacer un enlace, debemos considerar pares no compartidos. Estos suelen encontrarse en átomos como el oxígeno y el nitrógeno, aunque no solemos atraerlos a menos que los necesitemos. ¿Existe tal par en el oxígeno del agua? Si hacemos nuestros cálculos de electrones con cuidado, la respuesta es sí, y ese par ataca al átomo de carbono cargado positivamente. (El agua actúa como una base de Lewis, un donante de pares de electrones, y el carbono actúa como un ácido de Lewis y un aceptor de pares de electrones. El carbono tiene solo seis electrones en sus enlaces sigma y tiene una vacante para un par de electrones. Verifique el cargo formal para verificar esto.)
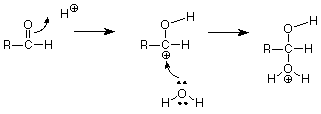
Esto hace que el enlace carbono-oxígeno final. Lo que queda (si comparamos esta estructura con nuestro producto) es romper el enlace carbono-hidrógeno final. Al hacerlo, con los electrones de ese enlace convirtiéndose en un par no compartido sobre el oxígeno, nos da un H + para reemplazar el que inició la reacción para que el H + catalítico no se agote. Esta secuencia de pasos mediante los cuales se logra la ruptura y realización de los enlaces requeridos se denomina mecanismo.
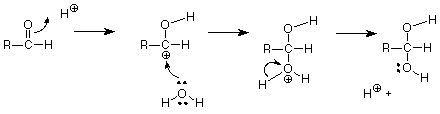
Si resumimos, otra forma de describirlo es decir que el ácido de Lewis H + ataca al par de electrones del enlace carbono-oxígeno pi. El carbono cargado positivamente (carbocatión) que resulta es también un ácido de Lewis y es atacado por el par no compartido del oxígeno del agua, actuando como una base de Lewis. Finalmente el ácido de Lewis H + se regenera por escisión del enlace oxígeno-hidrógeno de la misma manera que H 3 O + sirve como fuente de H +
Electrófilo-Nucleófilo
Los términos ácido de Lewis y base de Lewis son útiles, pero cuando estamos hablando de hacer y romper enlaces a los carbonos, encontramos que otros dos términos son más generales. Utilizamos el término electrófilo para designar átomos o grupos que forman enlaces mediante el uso de pares de electrones de otro átomo. El carbono cargado positivamente anterior es un ejemplo. Es atacado por el oxígeno del agua, utilizando el par no compartido del oxígeno. Usamos el término nucleófilo para designar el átomo o grupo que dona los electrones para hacer tal nuevo enlace al carbono. En nuestro ejemplo, el átomo de oxígeno está sirviendo como nucleófilo. Otra forma de decir esto es que los nucleófilos hacen enlaces usando sus propios pares de electrones. Los electrófilos hacen enlaces usando los pares de electrones de los nucleófilos. Podemos identificar esos roles en nuestro mecanismo de la siguiente manera:
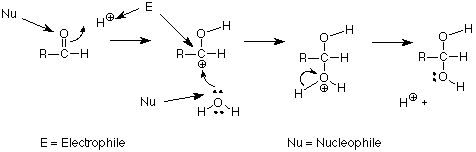
Un resumen de la reactividad del grupo carbonilo es que los electrófilos atacan al oxígeno; los nucleófilos atacan al carbono. Encontraremos que esta es una forma muy útil de organizar lo que aprendemos sobre muchas otras reacciones de los grupos carbonilo.
Ahora bien, use estos principios para elaborar un mecanismo para la adición catalizada por bases de agua a un grupo carbonilo. Algunas sugerencias: categorizar el OH —como un nucleófilo o electrófilo. Recuerda romper el enlace pi para evitar tener cinco enlaces al carbono. Lleve un registro de los cambios en la carga en átomos particulares.


