1.1: Introducción
- Page ID
- 70189
El desafío de la planificación sintética es la identificación de un conjunto de precursores disponibles que pueden combinarse y manipularse mediante una serie de reacciones químicas para proporcionar el objetivo sintético. El análisis a priori no tiene que proceder de la diana a los materiales de partida a lo largo del reverso exacto de la síntesis real (es decir, análisis retrosintético), pero este protocolo es altamente efectivo para el análisis de estructuras complejas moléculas porque proporciona una base lógica para el reconocimiento sistemático de posibles vías sintéticas. Por ejemplo, características reconocibles de los precursores los predisponen hacia reacciones químicas que generan el objetivo. Estas características son el resultado de ciertas características estructurales de los precursores (por ejemplo, la funcionalidad), cuyo residuo suele ser evidente en la diana y a partir de los cuales se puede inferir el precursor. El símbolo ⇒ se utiliza para indicar uno o más pasos hacia atrás, a menudo denominados dislocaciones o transformaciones del objetivo en un precursor. Los enlaces seccionados en una dislocación (es decir, generados durante la síntesis) se indican dibujando líneas onduladas a través de los enlaces apropiados. Además, el objetivo generalmente se mostrará a la izquierda del símbolo ⇒ y el precursor o precursores a la derecha.La dislocación puede corresponder a una única reacción química conocida, o una reacción hipotética, o puede ser el resultado de un proceso retrosintético de varias etapas. Por ejemplo, el grupo hidroxilo en un alcohol secundario puede verse como el resto del grupo funcional carbonilo que predispone un aldehído precursor hacia la reacción con un reactivo de Grignard para suministrar la diana sintética. El enlace C=C en un ciclohexeno puede verse como el residuo del sistema pi en 1,3-butadienodieno que predispone a este precursor hacia una cicloadición de Diels-Alder con acrilato de metilo para suministrar la diana sintética.

Las siguientes dislocaciones de algunas moléculas que consideraremos más a fondo en capítulos posteriores muestran solo las dianas y un conjunto de materiales de partida, precursores que son químicos orgánicos fácilmente disponibles. Así, la estrategia general de cada síntesis total se resume en una única dislocación de la diana. El sistema de numeración molecular de la diana sintética se adopta para designar los átomos correspondientes de precursores sintéticos. Los ejemplos en los gráficos 1-3 proporcionan una visión de la diversidad de soluciones posibles para un problema sintético particular. Los procedimientos sistemáticos que guían la invención de tales estrategias son el foco de este libro.
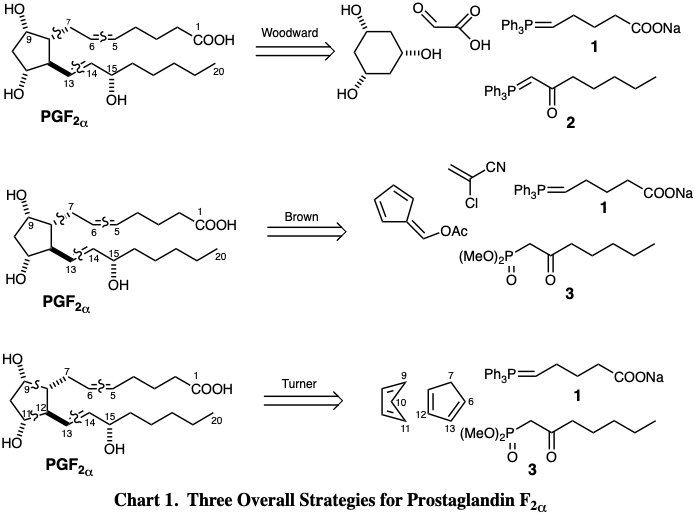
En el Cuadro 1 se presentan tres estrategias globales para la síntesis total de prostaglandina\(F_{2\alpha}\) (\(PGF_{2\alpha}\)) un derivado de ácido graso. Estos ejemplos constituyen una pequeña muestra de las numerosas estrategias que se han aplicado a la síntesis total de este importante producto natural. 1 Estas y otras síntesis de prostaglandinas serán consideradas en detalle en el capítulo 3. Cada estrategia en la tabla 1 utiliza el mismo material de partida 1 para los carbonos 1-5 de la cadena lateral superior y materiales de partida similares 2 o 3 para los carbonos 14-20 de la cadena lateral inferior. Pero se emplean precursores muy diferentes para las porciones C6-7 y C8-13 del objetivo. Así, la estrategia de Woodward implica la contracción del anillo de un anillo de seis miembros para generar el ciclopentano de C8-12 con C13 agregado y ácido glioxálico para proporcionar los carbonos 7 y 8. 2 La estrategia Brown 3 utiliza α-cloroacrilonitrilo para estos carbonos y acetoxifulveno como precursor para la porción de la diana que es proporcionada por ciclohexanotriol en la síntesis de Woodward. La estrategia de Turner talla el núcleo de ciclopentano, C8-12, a partir del dímero Diels-Alder de ciclopentadieno fácilmente disponible. 4 Así, los carbonos 9-11 se derivan de una molécula de ciclopentadieno mientras que los carbonos 6-8 y 12-13 se derivan de una segunda molécula de ciclopentadieno.
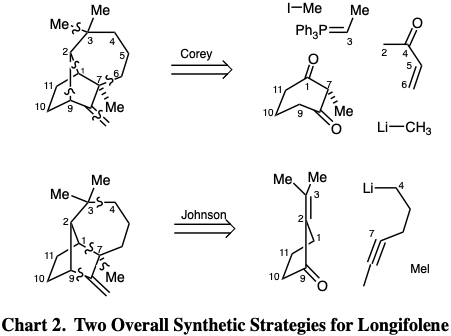
Dos estrategias para la síntesis total del sesquiterpeno longifoleno se presentan en la Tabla 2. La síntesis de Corey 5 construye el esqueleto tetracíclico a partir de un precursor de ciclohexan-1,3-diona que proporciona los carbonos 1 y 7-11. La estrategia 6 de Johnson construye la misma red de carbono a partir de un precursor de ciclopentano que proporciona los carbonos 1-3 y 9-11 de la diana. Los lazos formados en los dos enfoques son completamente diferentes.
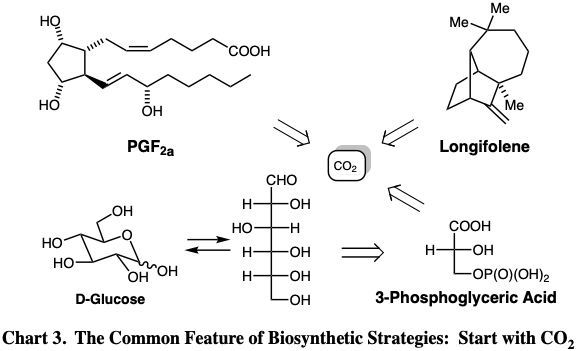
Si bien las elecciones de los materiales de partida en los ejemplos anteriores pueden parecer misteriosas, considere la estrategia aún más notable para la síntesis de estas moléculas en la naturaleza. Como se resume en la Tabla 3, todos los átomos de carbono de todos los productos naturales se derivan del mismo material de partida, el dióxido de carbono. La biosíntesis de bloques de construcción biosintéticos más complejos, por ejemplo, el ácido 3-fosfo-D-glicérico y la D-glucosa\(\ce{CO2}\) serán nuestro punto de partida para examinar la lógica que se puede aplicar al diseño de síntesis totales de moléculas orgánicas. La biosíntesis de productos naturales es un marco conveniente para una visión general sistemática de la síntesis total de una variedad de tipos estructurales orgánicos. Se considerará la lógica de cada biosíntesis y luego se comparará con las estrategias empleadas en las síntesis totales de laboratorio del mismo producto natural.
Primero, sin embargo, en las secciones restantes de este capítulo, se presentarán algunos principios básicos de planeación sintética. En el capítulo 2 se examinará la biosíntesis de glucosa y otros azúcares a partir del dióxido de carbono en las reacciones oscuras de la fotosíntesis. Los azúcares no son dianas sintéticas esqueléticamente complejas, pero su complejidad funcional y estereoquímica es un desafío significativo para el diseño sintético. El capítulo 2 concluye con una breve consideración de la síntesis total enantioselectiva de azúcares. Los capítulos siguientes examinan la lógica de la biosíntesis y las correspondientes síntesis totales de productos naturales estructuralmente complejos de las familias de ácidos grasos, terpenoides, policétidos y alcaloides. Una característica importante de la discusión es la inclusión de planes infructuosos surgidos del trabajo de destacados practicantes del arte y la ciencia de la síntesis total orgánica. Estos ejemplos enfatizan los límites prácticos de la planeación sintética incluso por parte de expertos en la materia.
Algunos libros anteriores sobre los principios, la lógica, las estrategias y las tácticas del diseño de síntesis y estudios de síntesis totales de moléculas orgánicas complejas se describen brevemente en la siguiente lista.
A. A. Akhrem, A. A. Tittov, A. Yu, Total Steroid Synthesis (Plenum, Nueva York, NY, 1970): discute brevemente algunos principios de la síntesis total y luego esboza exhaustivamente la síntesis total de esteroides oganizados de acuerdo con categorías topológicas de construcción esquelética.
N. Anand, J. S. Bindra, y S. Ranganathan, Art in Organic Synthesis (Holden-Day, Inc., San Francisco, primera edición, 1970): presentaciones de diagramas de flujo de síntesis de moléculas orgánicas complejas ocasionalmente acompañadas de breves discusiones sobre aspectos estratégicos destacados.
N. Anand, J. S. Bindra, y S. Ranganathan, Art in Organic Synthesis (John Wiley, Nueva York, segunda edición, 1987): presentaciones actualizadas de diagramas de flujo de síntesis de moléculas orgánicas complejas ocasionalmente acompañadas de breves discusiones sobre aspectos estratégicos destacados.
John ApSimon, Ed., The Total Synthesis of Natural Products, Vols. 1-9 (John Wiley & Sons, Nueva York, 1973-1992): Una colección de encuestas gráficas organizadas por familias biosintéticas.
J. S. Bindra y R. Bindra, La creatividad en la síntesis orgánica (Academic Press, Inc., Nueva York, 1975):
R. T. Blickenstaff, A. C. Gosh, G. C. Wolf, Química Orgánica Vol. 30: Síntesis total de esteroides (Academic Press, Nueva York, 1974): esboza exhaustivamente las síntesis totales de esteroides oganizados según categorías topológicas de construcción esquelética.
E. J. Corey y Xue-Min Cheng, La lógica de la síntesis química (John Wiley & Sons, Nueva York, 1989): duscusses los principios del diseño sintético luego proporciona ejemplos específicos mediante una presentación exhaustiva de las exitosas síntesis de Corey en formato de esquema con poca o ninguna discusión.
Samuel E. Danishefsky y S. Danishefsky, Progreso en síntesis total (Appleton-Century-Crofts, Nueva York, 1971): esquemas gráficos de síntesis totales de productos naturales organizados por familias biogenéticas acompañadas de una discusión de aspectos estratégicos destacados.
Ian Fleming, Selected Organic Syntheses (Wiley-Interscience, New York, 1973): analiza las reacciones clave en las síntesis totales de más de dos docenas de moléculas orgánicas complejas, siendo la mayoría productos naturales. Presenta múltiples síntesis de varias moléculas, es decir, Cecropia Hormona Juvenil y Colchicina, brindando una oportunidad de comparación de diferentes enfoques.
J. Furhop, G. Penzlin, Síntesis orgánica. Conceptos, Métodos, Materiales de partida (Verlag Chemie: Weinheim, Fed. Rep. Ger., 1983): discusión sistemática exhaustiva de métodos sintéticos organizados por sintones, relaciones difuncionales e interconversiones de grupos funcionales seguido de una consideración de los principios del análisis retrosintético y resúmenes gráficos para síntesis de una amplia variedad de complejos orgánicos moléculas.
S. Hanessian, Total Synthesis of Natural Products: The 'Chiron' Approach (Pergamon Press, Londres, 1983): conceptos para diseñar síntesis totales de productos naturales usando productos naturales quirales no racémicos fácilmente disponibles como materiales de partida se discuten y se ilustran extensamente con ejemplos .
Robert E. Ireland, Organic Synthesis (Prentice-Hall, Englewood Cliffs, New Jersy, 1969): A una discusión de los principios del diseño sintético le sigue una consideración detallada de ejemplos específicos de síntesis exitosas.
Thomas Lindberg, Ed., Strategies and Tactics in Orgainc Synthesis, Vols. 1-3 (Academic Press, Inc., Nueva York, 1984-1991): historias de casos anecdóticos de síntesis totales específicas que ilustran el diseño y ejecución de planes sintéticos y revelan los obstáculos y fallas comúnmente encontradas incluso por expertos.
Bradford P. Mundy, Concepts of Organic Synthesis (Marcel Dekker, Nueva York, 1979): una revisión de métodos sintéticos organizados de acuerdo a objetivos específicos o tipos de reacción como la formación de anillos o reordenamientos respectivamente. También se discuten la biosíntesis de terpenos, conceptos de estereocontrol y planeación sintética, y ejemplos de síntesis complejas.
Koji Nakanishi, Toshio Goto, Shoo Ito, Shinsaku Natori, Shigeo Nozoe, Eds., Natural Products Chemistry, Vols 1-3 (Academic Press, Inc., Nueva York, 1974-1983): información sobre la caracterización estructural y esquemas de síntesis totales organizadas por familias biogenéticas.
Fèlix Serrratosa, Estudios en Química Orgánica 41, Química Orgánica en Acción El diseño de la síntesis orgánica (Elsevier, Amsterdam, 1990): un libro de texto sobre los principios del diseño de síntesis incluyendo el uso de computadoras que concluye con varios ejemplos incluyendo varios estratégicamente diferentes síntesis de twistano y luciduleno.
Stephen Turner, The Design of Organic Synthesis (Elsevier, Nueva York, 1976): discute sistemáticamente principios de planeación de síntesis con ejemplos de considerable complejidad. El enfoque está en los conceptos, y no se proporciona una discusión exhaustiva de síntesis totales específicas.
Stuart Warren, Organic Synthesis: The Disconnection Approach (John Wiley & Sons, Nueva York, 1982): presenta principios de planeación de síntesis a un nivel muy simple. Se definen conceptos, especialmente el análisis retrosintético, y sus aplicaciones se ejemplifican sistemáticamente mediante el diseño de síntesis cortas de dianas simples.
- Para una monografía reciente, véase: “Nuevas rutas sintéticas a prostaglandinas y tromboxanos”, Roberts, S.M.; Scheinmann, F., Academic Press, Nueva York (1982).
- Woodward, R.B.; Gosteli, J.; Ernest, I.; Friary, R.J.; Nestler, G.; Raman, H.; Sitrin, R.; Suter, C.; Whitesell, J.K. J. Am. Chem. Soc. 1973, 95, 6853.
- Brown, E.D.; Lilley, T.J. Chem. Commun. 1975, 39.
- Brewster, D.; Myers, M.; Ormerod, J.; Otros, P.; Smith, A.C.B.; Spinner, M.E.; Turner, S. J. Chem. Soc. Perkin I, 1973, 2796.
- Corey, E.J.; Ohno, M.; Vatakencherry, P.A.; Mitra, R.B. J. Am. Chem. Soc. 1964, 86, 478.
- Volkmann, R.A.; Andrews, G.C.; Johnson, W.S. J. Am. Chem. Soc. 1973, 97, 4777.


