1.2: Análisis centrado en la lógica
- Page ID
- 70199
Análisis Retrosintético Exhaustivo
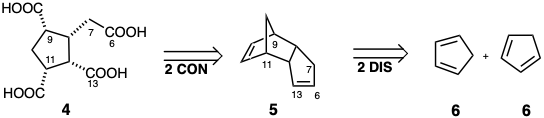
Se deben establecer tres cosas para lograr la síntesis total de una molécula orgánica. Estas son las adecuadas (1) red de carbono, (2) funcionalidad y (3) estereoquímica. La red de carbono consiste en átomos de carbono y un conjunto de conexiones entre ellos. Un exhaustivo análisis retrosintético del problema de la síntesis de una molécula orgánica compleja incluiría la consideración de todas las estrategias posibles que involucran cada enlace C-C como la última conexión hipotética en la construcción esquelética, una desconexión (DIS) en el análisis retrosintético. Además, puede ser ventajoso generar intermedios que contengan enlaces no presentes en la diana final. Estos enlaces deben ser seccionados en alguna etapa de la síntesis. Por ejemplo, considere una síntesis del ácido tetracarboxílico 4. Esta diana podría obtenerse fácilmente por escisión oxidativa de endo - diciclopentadieno (5), fácilmente disponible por dimerización de ciclopentadieno (6). Al planear tal síntesis, estas escisiones de enlaces corresponden a dislocaciones que generan conexiones (CON). Por lo tanto, un análisis exhaustivo también debe considerar todas las posibles escisiones de enlaces que podrían generar el esqueleto deseado a partir de un precursor más altamente conectado.
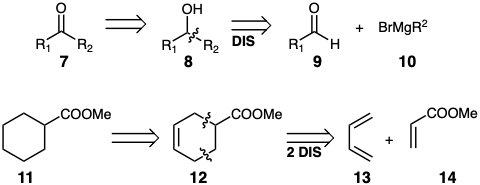
Además de establecer el esqueleto de carbono requerido a partir de precursores disponibles mediante la formación o escisión de enlaces C-C, la generación de una diana sintética puede requerir la manipulación de grupos funcionales. Por lo tanto, las dianas sintéticas pueden contener una funcionalidad que es diferente a la de un precursor fácilmente disponible. Por ejemplo, una síntesis bien conocida de cetonas 7 implica la oxidación de precursores de alcohol 8 que, a su vez, a menudo se ensamblan por la unión de aldehídos 9 con reactivos de Grignard 10. Otro ejemplo lo proporciona una estrategia para la síntesis de ciclohexano 11. El ciclohexeno 12, que está fácilmente disponible a partir de 13 y 14, es un excelente precursor que suministraría el ciclohexano 11 tras la saturación del enlace C=C.
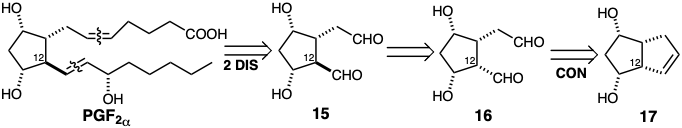
Finalmente, algunas reacciones no cambian la red de carbono ni modifican la funcionalidad, sino que simplemente alteran la estereoquímica. Por ejemplo, una posible dislocación del precursor 15\(PGF_{2\alpha}\) es la epimerización del estereocentro en la posición 12 ya que esto permite la generación de 16 a partir de un precursor bicíclico 17 fusionado cis fácilmente disponible.
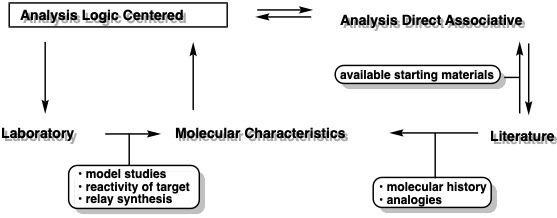
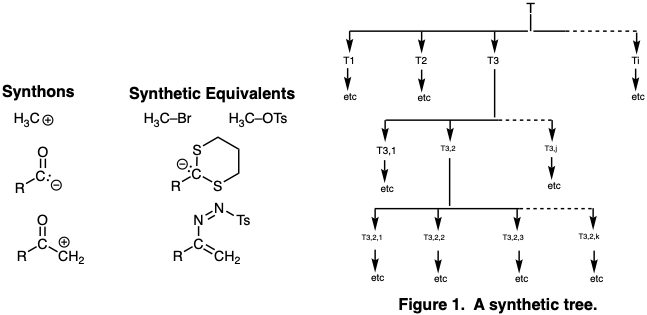
Un exhaustivo análisis retrosintético centrado en la lógica consideraría cada posible desconexión, conexión, modificación de grupos funcionales y modificación estereoquímica como un último paso potencial de la síntesis. Al hacerlo, un conjunto de estructuras subobjetivo (e.g. T 1, T 2, T 3. T i), que puede convertirse en una sola operación sintética, es decir, etapa química, a la diana sintética. El mismo proceso se aplica a cada subdiana y así sucesivamente hasta que la molécula se reduce a varios conjuntos de materiales de partida fácilmente disponibles, y se genera un árbol completo de intermedios sintéticos (a veces denominado árbol sintético) (Figura 1). A menudo es conveniente durante el proceso de planeación generalizar potenciales intermedios de un tipo particular. Dichos intermedios generalizados o sintones pueden corresponder a moléculas orgánicas estables o a fragmentos reactivos hipotéticos como un “catión metílico”, “carbanión acilo” o “α-ceto-carbocatión”. Los intermedios orgánicos reales correspondientes a diversos sintones se denominan equivalentes sintéticos. Así, yoduro de metilo, bromuro de metilo, cloruro de metilo, trifluorometanosulfonato de metilo o p-toluenosulfonato de metilo son todos equivalentes sintéticos del sintón “metil electrófilo”. Los equivalentes sintéticos de acil carbaniones y α-keto carbocationes se discutirán en la página 17. Por lo general, se genera un árbol sintético de sintones y se anotan posibles equivalentes sintéticos, pero la elección final de un equivalente sintético adecuado para cada sintón a menudo se determina por experimento durante la ejecución de la síntesis.
Condiciones de Límite
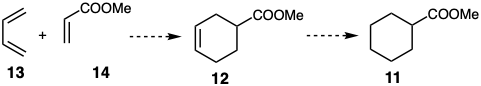
El análisis retrosintético centrado en la lógica que genera un árbol de sintones 7 es la base del análisis sintético asistido por computadora. 8 Incluso con la ayuda de una computadora, sin embargo, un análisis indiscriminadamente exhaustivo sería imposiblemente engorroso y de poco uso porque se invertiría mucho esfuerzo explorando vías que tienen poca o ninguna probabilidad de ser útiles. Más bien, es deseable identificar dislocaciones que es poco probable que sean fructíferas y abandonarlas, para podar el árbol sintético a medida que crece. Los objetivos del análisis reterosintético son: (1) la identificación de materiales de partida fácilmente disponibles y (2) una vía eficiente para su conversión en la diana sintética. Dado que los materiales de partida generalmente tendrán estructuras simples, es probable que las dislocaciones que reduzcan la complejidad molecular conduzcan a ellas. Esto recomienda siete condiciones límite para la selección de dislocaciones deseables. Así, una dislocación (o transformación) deseable debe (i) reducir la conectividad interna por escisión de anillos, (ii) reducir el tamaño molecular por desconexión de cadenas o apéndices, (iii) eliminar funcionalidad, y/o (iv) simplificar la estereoquímica, por ejemplo, mediante la eliminación de centros asimétricos. Las vías sintéticas que emergen bajo la guía de estas condiciones límite generarán rápidamente la complejidad molecular requerida de la diana y, por lo tanto, implicarán un número mínimo de pasos. Sin embargo, algunas dislocaciones que (v) aumentan la complejidad molecular también pueden ser deseables si facilitan una dislocación simplificadora. Por ejemplo, aumentar la complejidad molecular de 11 mediante la adición de insaturación sugiere una subdiana 12 que debería estar fácilmente disponible mediante una cicloadición 2π + 4π que genera dos enlaces C-C en una sola etapa a partir de los materiales de partida fácilmente disponibles 13 y 14. Si el enlace C=C en la subdiana 12 puede hidrogenarse selectivamente en presencia de un enlace C=O, entonces la diana final 11 podría obtenerse a partir de 12. Tenga en cuenta que en este libro se designará una síntesis hipotética con flechas discontinuas.
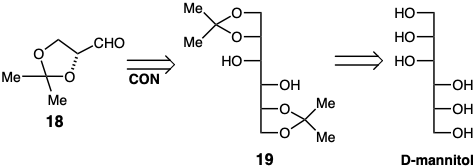
Otro ejemplo de una dislocación potencialmente deseable que aumenta la complejidad molecular lo proporciona una estrategia para preparar el cetal de gliceraldehído 18. Por lo tanto, una subdiana dimérica 19 debería proporcionar 18 por escisión oxidativa de la matriz funcional diol vecinal. Aunque 19 es estructural y funcionalmente más complejo que 18, sería un excelente precursor si se pudiera encontrar un método para cetalizar selectivamente las matrices de diol vecinales terminales en D-manitol, ya que el material de partida de hexitol es un producto económico derivado naturalmente.
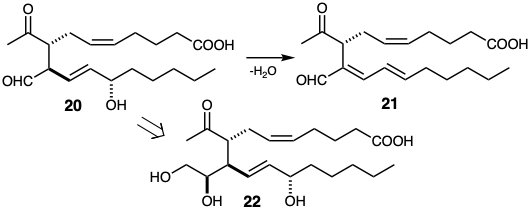
Otra condición límite se sugiere por la necesidad de (vi) evitar reacciones secundarias indeseables durante las primeras etapas de la síntesis total de una diana funcionalmente compleja. Por lo tanto, las reacciones secundarias son menos probables si se genera una matriz funcional sensible en la diana cerca del final de la síntesis. Reterosintéticamente, esto significa que las dislocaciones que modifican (por ejemplo, ocultan) o eliminan sitios de reactividad química o inestabilidad inusualmente altas son especialmente deseables. Por ejemplo, la matriz funcional δ-hidroxi-β, γ-aldehído insaturado en 20 es especialmente propensa a la deshidratación para dar el diéneo 21. El grupo funcional aldehído puede promover la deshidratación. Por lo tanto, se recomienda la generación del grupo aldehído en el último paso de la síntesis. Una posibilidad es usar una matriz funcional de diol vecinal en una subdiana 22 como aldehído oculto. Por supuesto, el éxito de esta estrategia depende de la viabilidad de lograr la escisión oxidativa de la subdiana estructural y funcionalmente más compleja 22 en condiciones de reacción adecuadamente suaves. Esto puede considerarse una estrategia riesgosa porque todo el esquema fallaría si no se puede lograr el último paso. Sin embargo, se puede probar la estabilidad de la diana a las condiciones de reacción que se requieren para escindir oxidativamente los dioles vecinales. Sin embargo, otras trampas potenciales probablemente solo se puedan probar en el propio subobjetivo 22. Por ejemplo, ¿22 tenderán a someterse a una cetalización intramolecular que no se puede revertir fácil y limpiamente? Por otro lado, los beneficios de encontrar un método para lograr la conversión de 22 a 20 justifican intentar la síntesis a través de esta subdiana.
El objetivo final de la planeación sintética es idear la síntesis más económica del objetivo. La idoneidad de una estrategia particular debe depender inevitablemente del estado del arte (¿ciencia?). Como la disponibilidad de materiales de partida o métodos (nuevos o más efectivos) para unirlos y manipularlos varía, también lo harán los méritos relativos de diferentes vías. Dicho de otra manera, una mala síntesis puede convertirse en el método de elección si se puede descubrir un método para mejorar un mal paso. Incluso un enfoque “centrado en la lógica” no puede producir respuestas absolutas. Lo que puede hacer es generar sistemáticamente un gran número de estrategias alternativas para su consideración a la luz del conocimiento químico existente.
Otro concepto que puede guiar el crecimiento fructífero de un árbol sintético es la identificación de características objetivo que dirigen especial atención a un método sintético particular o material de partida y, así, canalizan la elección de las dislocaciones. Por ejemplo, un anillo de seis miembros invita a considerar una cicloadición de Diels-Alder como hemos visto anteriormente en una estrategia para la síntesis de 11 de 13 más 14. De manera similar, debido a la estabilidad asociada a la aromaticidad, la presencia de un anillo aromático en una diana sintética recomienda la consideración de precursores aromáticos porque: (1) su estabilidad puede evitar reacciones secundarias indeseables y (2) una gran variedad de compuestos aromáticos están fácilmente disponibles.
Los hechos que: (1) las reacciones químicas son el medio para lograr la construcción esquelética, y (2) la funcionalidad facilita las reacciones químicas, recomienda una condición límite que favorezca estrategias sintéticas que hagan (vii) el máximo uso de la funcionalidad relacionada con la diana en precursores de la construcción esquelética pro- mota. “" "Relacionado con la diana "” se refiere a la funcionalidad en precursores que pueden ser idénticos o estrechamente relacionados con la funcionalidad en la diana sintética final.”
La imposición de condiciones límite durante la generación de un árbol sintético puede eliminar la necesidad de considerar una gran fracción de posibles vías sintéticas. Por ejemplo, al idear una síntesis de prostaglandina\(F_2\alpha\) desfavoreceríamos todas las vías que implican una conexión final entre cualquiera de los carbonos 16-20 que constituyen un grupo n-pentil. Este grupo de átomos es un resto no funcionalizado no reactivo. La unión de dos sintones en cualquiera de estos enlaces requeriría una extensa manipulación funcional sin justificación obvia. Dichas estrategias no hacen el máximo aprovechamiento de la funcionalidad.
Estrategias Asociativas Directas
Las síntesis de algunas moléculas diana o subdianas no requieren el enfoque analítico riguroso centrado en la lógica, ya que las moléculas pueden reconocerse como derivadas de la unión de una serie de subunidades no disfrazadas fácilmente disponibles que pueden ser reunidas de la manera adecuada usando reacciones estándar. Esto se conoce como un enfoque asociativo directo a la planeación sintética. Así, por ejemplo, las estrategias para la síntesis de polipéptidos, casi sin excepción, implican la unión de aminoácidos o derivados adecuados mediante la creación de enlaces amida.
Generalmente, la planificación sintética para moléculas complejas es intermedia entre un enfoque asociativo directo y uno centrado en la lógica. El proceso de reconocimiento inicial puede usar análisis centrado en la lógica hasta que se hagan evidentes varias subunidades potencialmente disponibles o intermedios clave. La elección de un intermedio clave particular como punto de partida canaliza y simplifica el análisis. A esto le sigue un análisis cuidadoso, generalmente centrado en la lógica, de secuencias detalladas que conducen a las subunidades deseadas y de ellas a la diana sintética.
Así, el objetivo práctico del análisis centrado en la lógica es reducir una molécula compleja a un conjunto de sintones “fácilmente disponibles” o “reconocibles”. Es decir, simplificar el objetivo sintético en la medida en que se haga factible un enfoque asociativo directo. Un conocimiento de lo que está fácilmente disponible no tiene por qué preceder a la simplificación del problema centrada en la lógica. Las estructuras simplificadas generadas por dicho análisis pueden, por el contrario, convertirse en objeto de una búsqueda exhaustiva de la literatura química. Esta búsqueda puede comenzar con una base de datos de computadora como Chemical Abstracts Online o una de las siguientes referencias generales:
a) H.O. House, “Modern Synthetic Reacciones”, 2a ed., Benjamin, 1972.
b) R.B. Wagner y H.D. Zook, “Química Orgánica Sintética”, Wiley, 1953.
c) C.A. Buehler y D.E. Pearson, “Survey of Organic Synthesis”, Wiley, 1970.
d) A.I. Vogel, “Química Orgánica Práctica”, 3red ed, Wiley, 1956.
e) I.T. Harrison y S. Harrison, “Compendio de Métodos Sintéticos Orgánicos”, Wiley, 1971.
f) L.F. Fierser y M. Fierser, “Reactivos para Síntesis Orgánica”, Wiley.
g) “Reacciones orgánicas”, Wiley.
(h) “Síntesis Orgánica”, Wiley.
(i) “Nuevos Métodos de Química Orgánica Preparativa”, Prensa Académica.
La información obtenida de la literatura sobre enfoques sintéticos establecidos para estructuras similares puede ser utilizada para generar refinamientos adicionales del plan sintético mediante análisis centrado en la lógica. Este procedimiento general para la planeación sintética es un enfoque interactivo. Además, la planeación sintética generalmente no termina cuando se inicia el trabajo en el laboratorio. La información sobre la reactividad molecular obtenida en el laboratorio puede ser aprovechada para modificar o generar nuevas estrategias. A continuación se resumen las interacciones entre los modos de análisis y las fuentes de información relevante.