4.2: Reordenamiento Aza-Claisen y reacciones relacionadas
- Page ID
- 73227
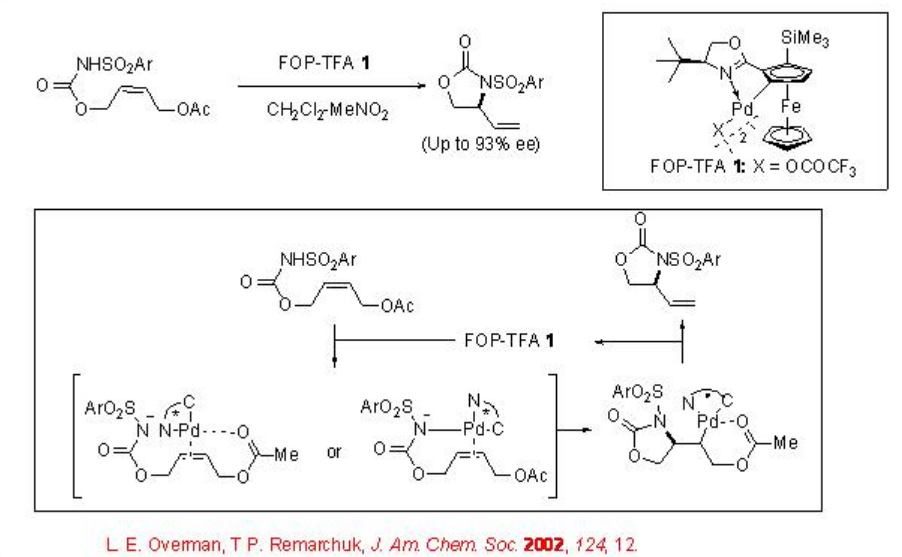
El reordenamiento Aza-Claisen, conocido como el reordenamiento Overman, ha sido ampliamente estudiado que nos permite sintetizar aminas alílicas quirales a partir de imidatos alílicos aquirales con excelente enantioselectividad. Por ejemplo, los N-arilbencimidatos proquirales se pueden convertir en N-a-rilbenzamidas quirales en presencia de paladaciclo de ferroceniloxazolina, FOP-TFA, (Esquema\(\PageIndex{1}\)).
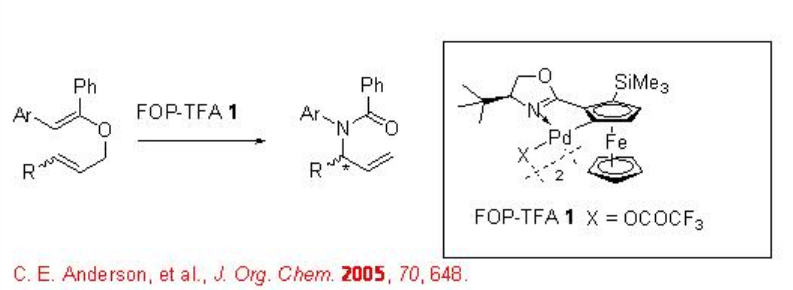
También se ha demostrado que este sistema catalítico promueve la ciclación de los carbamatos de N - arilsulfonilo alílicos para dar heterociclos que contienen nitrógeno de cinco eslabones (Esquema 2). Se ha propuesto una implicación de la aminopaladación del alqueno seguida de la inserción del alqueno en el Pd-N.
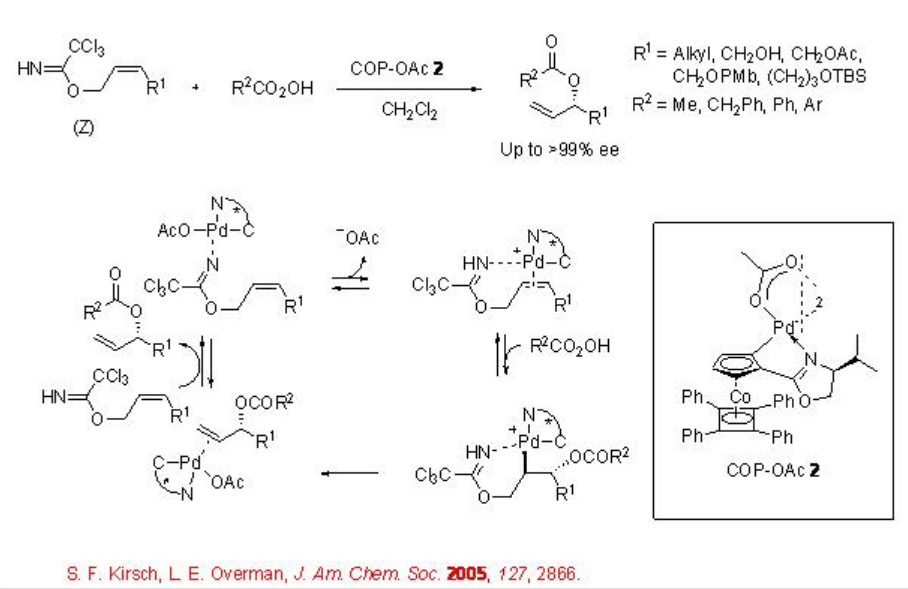
Este procedimiento también se ha extendido para la reacción de eterificación alílica. Por ejemplo, la reacción de tricloroacetimidatos (Z) -alílicos con ácidos carboxílicos en presencia de CoP-OAc 2 da ésteres alílicos quirales en alta enantiopureza (Esquema\(\PageIndex{3}\)). Bajo estas condiciones de reacción, el estereoisómero E muestra resultados inferiores. En estas reacciones, el CoP-OAc activa el doble enlace carbono-carbono para el ataque por nucleófilo de oxígeno externo y el grupo tricloroacetimidato sirve como grupo lábil junto con la conformación del catalizador al doble enlace.