6.1: Reacciones dobles enlaces carbono-carbono
- Page ID
- 73387
La reducción enantioselectiva del doble enlace C=C tiene una aplicación importante en la síntesis de muchos productos naturales y compuestos de importancia farmacéutica. Esquema\(\PageIndex{1}\) resume algunos de los ligandos quirales basados en fosfina exitosos comunes desarrollados para la hidrogenación asimétrica catalítica de alquenos.
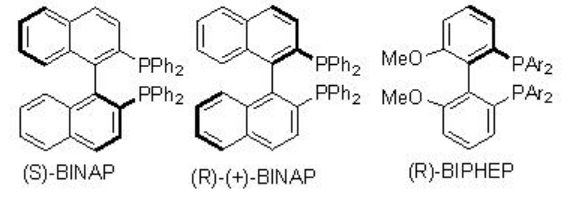
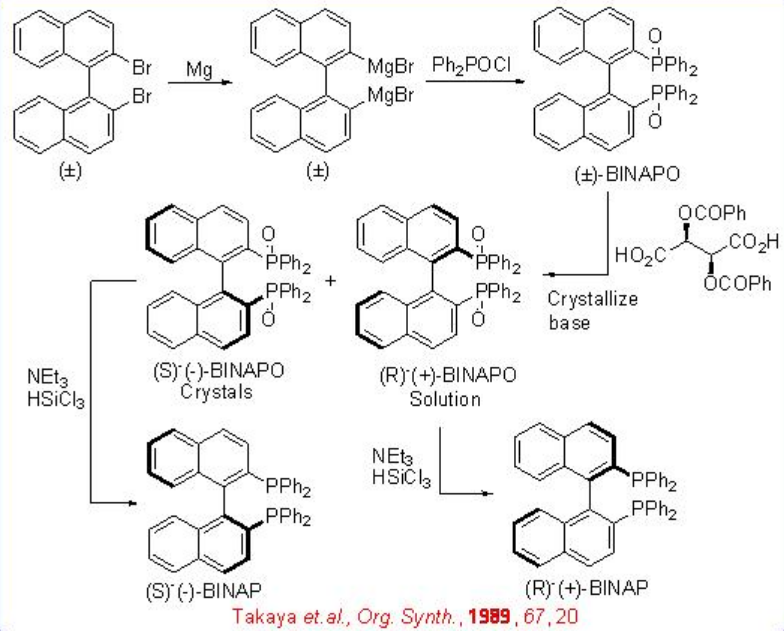
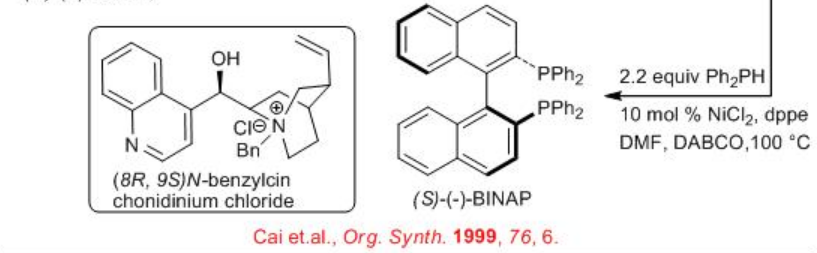
Los ligandos basados en BINAP desempeñan un papel importante en la hidrogenación asimétrica de alquenos. Tanto (S) - BINAP como (R) - BINAP podrían sintetizarse por métodos de resolución utilizando (1S,2S) - ácido tartárico así como (8R,9S) - N - cloruro de bencilcinconídinio como fuentes quirales. Síntesis de (S) - BinapPodría realizarse a partir de 2,2'-dibromo BINAP racémico (Esquema\(\PageIndex{2}\)). La resolución del óxido de fosfina correspondiente con (1S,2S) - ácido tartárico y posterior reducción con HSiCl 3 puede proporcionar (S) - BINAP en escala de gramos.
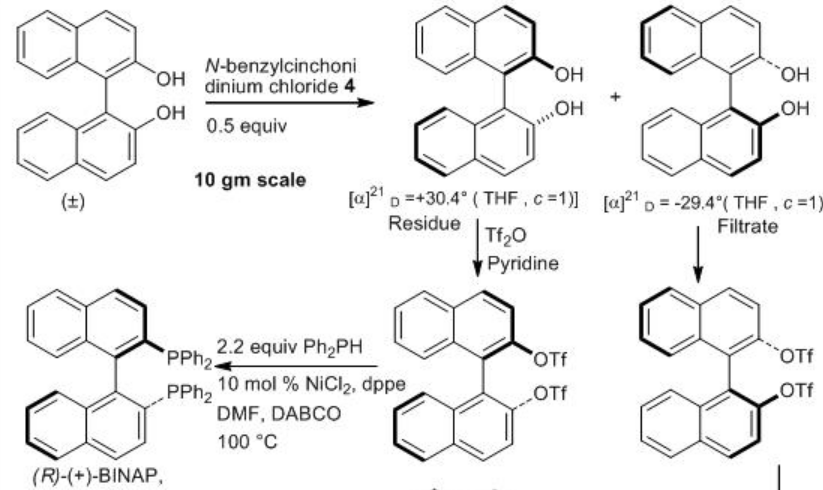
Alternativamente, (S) - BINAP y (R) - BINAP pueden sintetizarse por resolución de BINOL racémico usando cloruro de (8R,9S) - N - bencilcinconidinio (Esquema\(\PageIndex{3}\)). Convertirlos en derivados de triflato y posterior acoplamiento cruzado con PH Ph 2 usando NiCl 2 para proporcionar (S) - BINAP y (R) - BINAP en escala de gramos. (S) - BINAP; sólido marrón claro, mp 205°C, 99% ee, [α] 21 D = −29.4° (THF, c =1). (R) - BINAP; sólido cristalino blanco, mp 207°C, 99% ee, [α] 21 D = 26.2 - 30.9° (THF, c 1).
6.1.1 Reducción de ácidos carboxílicos α, β -insaturados
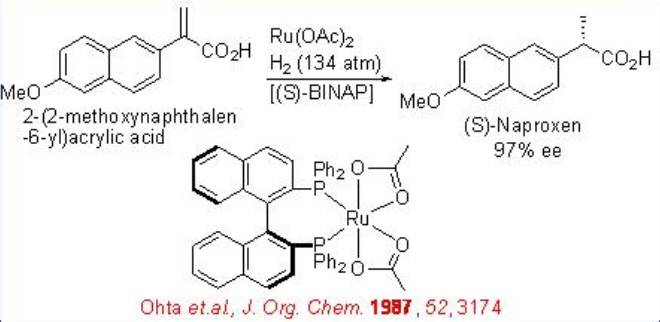
El Ru quiral (II) -BINAP cataliza la hidrogenación de ácidos carboxílicos α, β - insaturados. Por ejemplo, la hidrogenación de ácido naftacrílico se puede realizar usando un Ru- (S) -BINAP con 134 atm H 2 de presión (Esquema\(\PageIndex{4}\)). La reacción proporciona (S) -Naproxeno quiral con 98% ee, que es un fármaco antiinflamatorio no esteroideo.
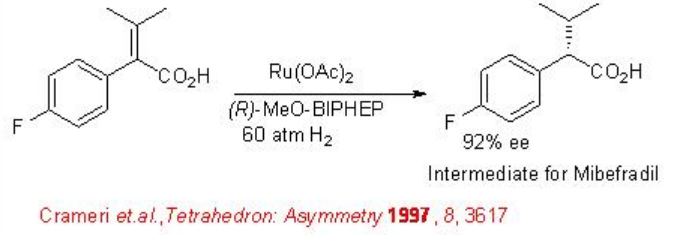
Se ha explorado la hidrogenación para la síntesis del intermedio de (S) - mibefradil. Para esta reacción se encuentra que el complejo quiral RU que lleva (R) -MeO-BiPhep es efectivo proporcionando el intermedio diana con 92% ee (Esquema\(\PageIndex{5}\)).
6.1.2 Reducción del alcohol alílico
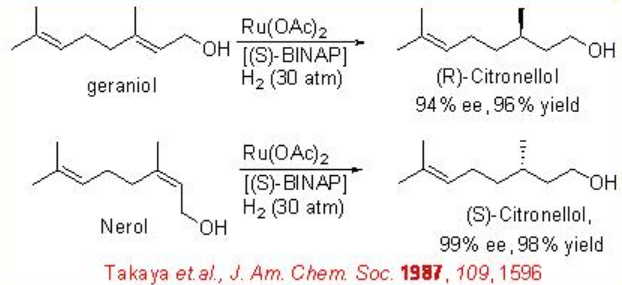
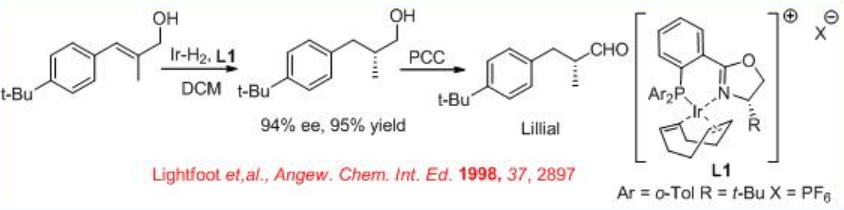
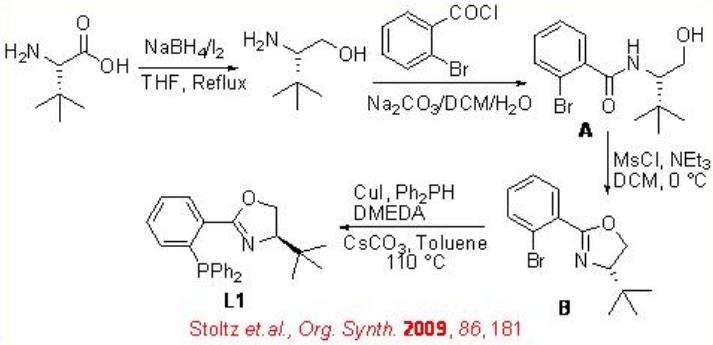
Los alcoholes alílicos se pueden reducir con alta selectividad usando Ru- (S) -BINAP quiral como catalizador. Por ejemplo, la reducción de geraniol se puede lograr con 94% ee (Esquema\(\PageIndex{6}\)). El producto reducido se utiliza para la síntesis a gran escala de L- (+) -mentol. Bajo estas condiciones, el nerol experimenta reducción para dar (S) -citronelol en 99% ee. Los sistemas catalíticos quirales basados en iridio también se han explorado posteriormente para la reducción asimétrica de alcoholes alílicos. Por ejemplo, el complejo que porta fosfanodihidrooxazol quiral L 1 cataliza la reducción asimétrica de un alcohol alílico, el cual se utiliza como paso clave en la síntesis de lillial (Esquema\(\PageIndex{7}\)). El esquema\(\PageIndex{8}\) ilustra la síntesis de fosfanodihidrooxazol quiral L 1.
6.1.3 Reducción de Aaminas Alílicas
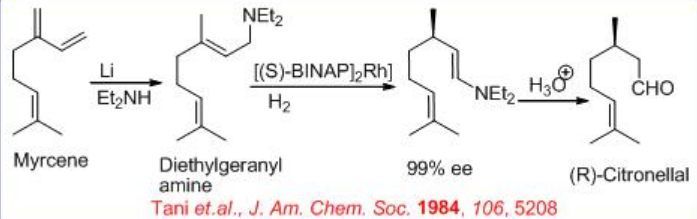
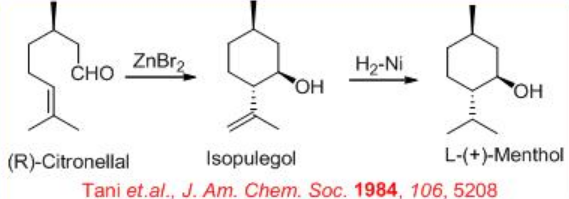
Paralelamente a la reducción del alcohol alílico, se ha utilizado el sistema Rh- (S) -BINAP para la reducción de la amina alílica. Por ejemplo, la síntesis de (R) - citronelal se puede lograr mediante la reducción de amina alílica (Esquema\(\PageIndex{9}\)). El paso clave es la isomerización de geranil dietilamina formando (R) -enamina citronelal. El complejo Rh realiza el reordenamiento de esta amina alílica a la enamina creando un nuevo centro quiral con > 98% ee, que tras la hidrólisis da (R) -citronelal en 96— 99% ee. Este último sirve como sustrato precursor para la síntesis de L- (+) -mentol mediante reacción de eno intramolecular seguida de hidrogenación (Esquema\(\PageIndex{10}\)).
6.1.4 Reducción de aldehídos α, β -insaturados
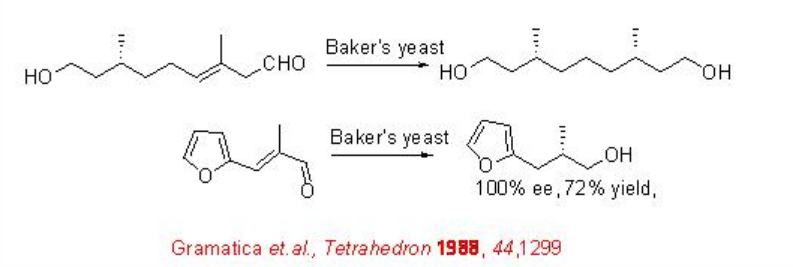
La reducción asimétrica de aldehídos α, β -insaturados con catalizadores de metales de transición aún no ha demostrado estar lista para una amplia aplicación industrial. En comparación con el catalizador de CBS, la levadura de Baker es más útil, ya que el precursor (R) -prolina utilizado para sintetizar CBS es caro. La reducción quiral de enales a alcoholes quirales usando levadura de Baker se conoce desde hace más de 30 años. Esquema\(\PageIndex{11}\) resume algunos de los ejemplos para la reducción catalizada por levaduras Baker de C=C de aldehídos α, β -insaturados.
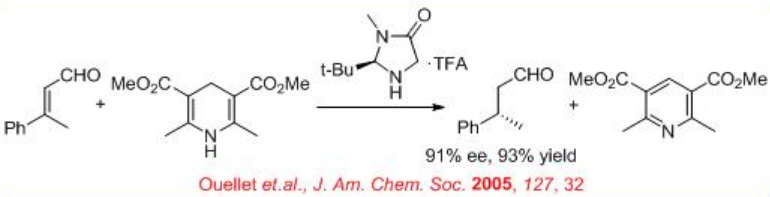
Posteriormente, se ha encontrado que la organocatálisis es efectiva para la reducción asimétrica. Un reciente desarrollo interesante es la reducción de la transferencia de hidruro organocatalítico de aldehídos α, β -insaturados a aldehído quiral. El éster de Hantzsch actúa como un buen imitador de NADH en la transferencia de hidruro a un ion iminio, formado cuando el aldehído α, β -insaturado reacciona con la amina del organocatalizador (Esquema\(\PageIndex{12}\)).
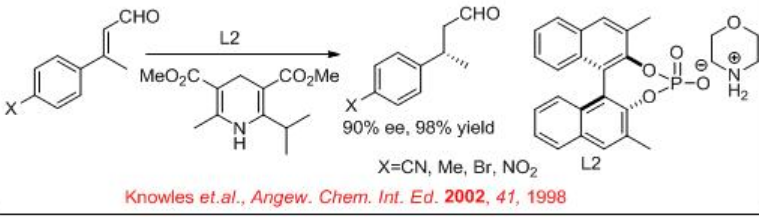
De igual manera, el ácido fosfórico quiral L2 cataliza la reducción de C=C de aldehído α, β -insaturado con 90% ee y 98% de rendimiento en presencia de éster de Hantzsch (Esquema\(\PageIndex{13}\)).
6.1.5 Reducción del α-Aminoácido α, β-insaturado
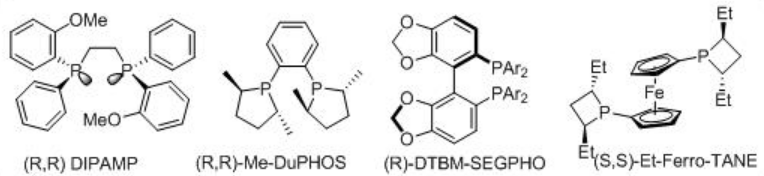
La reducción asimétrica del α-aminoácido α, β -insaturado tiene una amplia aplicación en la síntesis orgánica. Las bifosfinas quirales en combinación con Rh actúan como la mejor combinación para la reducción de los aminoácidos α, β-insaturados α. El esquema\(\PageIndex{14}\) resume algunas de las fosfinasquirales exitosas para las reacciones catalizadas por Rh.
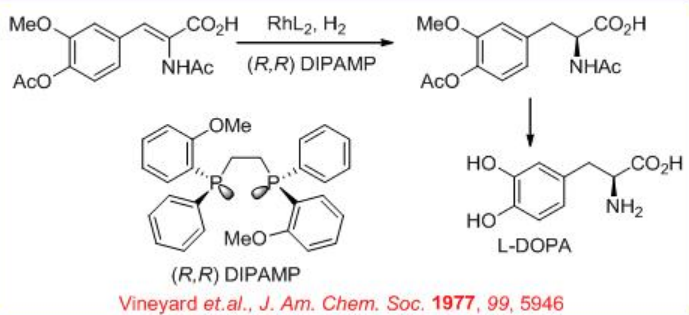
Se ha explorado Rh-dipamp para la reducción de α-aminoácidos β-insaturados. Por ejemplo, L-DOPA, un fármaco quiral para el tratamiento de la enfermedad de Parkinson, se sintetiza utilizando la reducción catalizada por Rh- (R, R) -DIPAMP de α, β-insaturado α -aminoácido como paso clave (Esquema\(\PageIndex{15}\)).
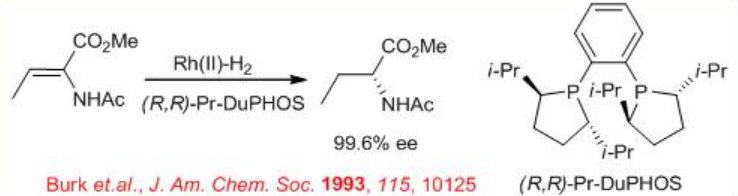
Rh - (R, R) - DuPhos se puede utilizar para la reducción de α, β-insaturado α-aminoácido para dar aminoácido quiral (Esquema\(\PageIndex{16}\)). Mediante este procedimiento, muchos de los α-aminoácidos no naturales se pueden obtener directamente con enantioselectividad cercana al 100% ee y una relación S/C 10000-50000. La hidrogenación catalizada por rodio de los isómeros E y Z, con BINAP en THF, proporciona productos con configuraciones absolutas opuestas. Notablemente, el sistema (R, R) - DuPhos proporciona una excelente enantioselectividad para ambos sustratos isoméricos con la misma configuración absoluta, independientemente de la geometría E/Z. Este resultado es particularmente importante para la construcción de derivados de alquil deshidroaminoácidos, que son difíciles de preparar en forma enantioméricamente pura.
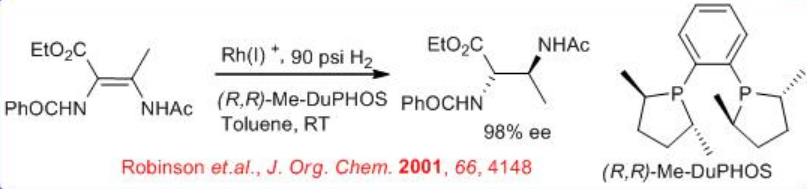
La hidrogenación del isómero (E) - o (Z) - de β- (acetilamino) - β-metil- α-deshidroaminoácidos con Rh (I) -Me-Duphos proporciona cualquiera de los diastereómeros de los derivados del ácido 2,3-diaminobutanoico N, N-protegidos con 98% ee (Esquema\(\PageIndex{17}\) -\(\PageIndex{18}\)).
(S) - SEGPHOS y sus análogos proporcionan resultados superiores en la hidrogenación catalizada por RU de lactonas o carbonatos cíclicos de cuatro y cinco miembros que portan un grupo metileno exocíclico. Por ejemplo, la reducción de la lactona de cuatro miembros se puede lograr con excelente enantioselectividad usando S/C=12270 (Esquema\(\PageIndex{19}\)).
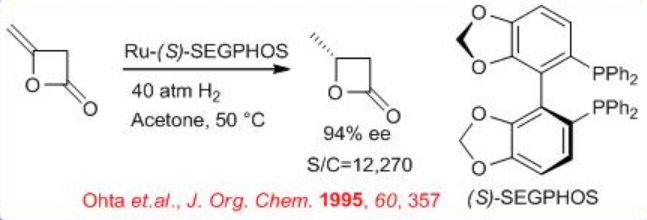
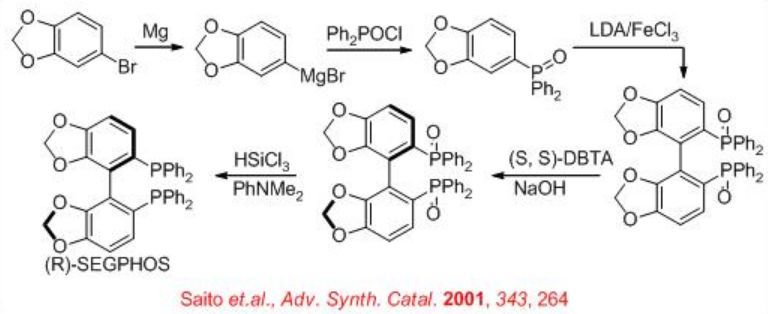
Esquema\(\PageIndex{20}\) describe la síntesis de SEGPHOS. El paso clave es la resolución del óxido de fosfina racémico con (S, S) - DBTA (ácido di-benzoil-tartárico) para proporcionar óxido de fosfina quiral. La posterior reducción con HSiCl 3 proporciona el SEGPHOS objetivo con buen rendimiento.
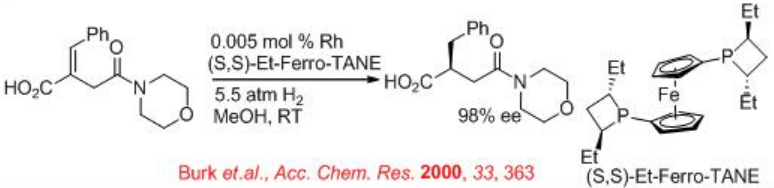
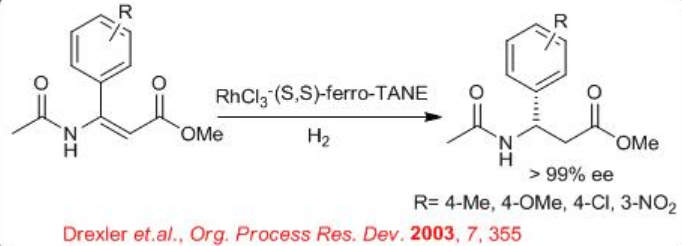
Además, el 1,10-difosfetanilferroceno et-Ferrotano quiral sirve como un ligando efectivo para la hidrogenación catalizada por rodio del monoamido itaconato sustituido con β -arilo y β -alquilo (Esquema\(\PageIndex{21}\)). Por ejemplo, Et-duphos-RH se utiliza para la hidrogenación asimétrica del alqueno trisustituido para proporcionar el producto reducido, el cual se utiliza para la síntesis del intermedio del fármaco candoxatril en 99% ee. Candoxatril es el profármaco activo por vía oral de la endopeptidasa neutra humana (Neprilisina) candoxatril (NK-73967).
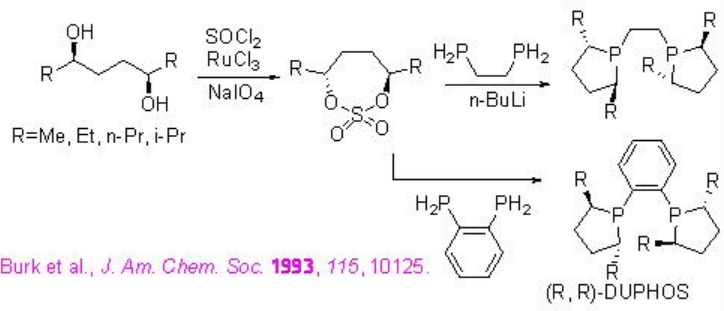
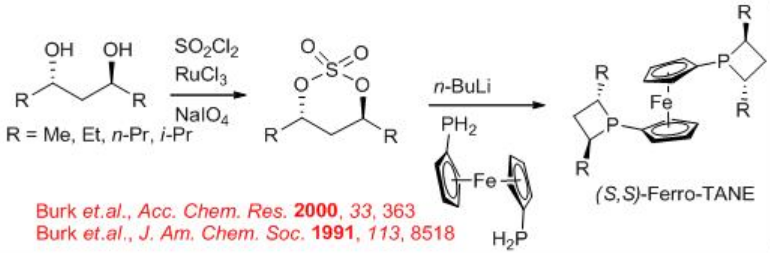
Los ligandos de la familia alquil/aril-ferro-tano descritos anteriormente podrían sintetizarse a partir de dioles ópticamente activos (Esquema\(\PageIndex{22}\)). La ciclación con SO 2 Cl 2 en presencia de RuCl 3 y NaIO 4 proporciona sulfonato ciclado quiral, el cual reacciona con ferrofosfina en presencia de n-BuLI para dar la familia quiral de alquil/aril-ferro-tano objetivo con buen rendimiento.
De igual manera, la reducción de α, α -disustituido α, β-éster insaturado se puede llevar a cabo utilizando Ru-Et-Ferro TANE quiral (Esquema\(\PageIndex{23}\)). La reacción es compatible con diferentes grupos donadores y extractores de electrones unidos al anillo de benceno.
6.1.6 Reducción de ácidos α-alquil sustituidos
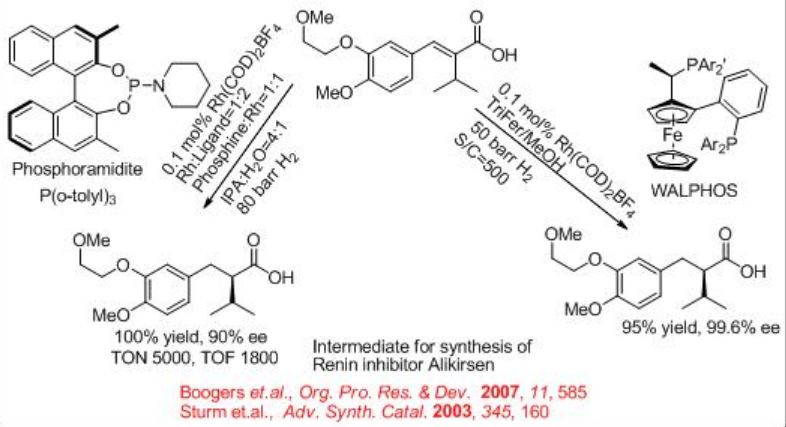
Otro ácido quiral importante es el ácido α-alquil sustituido que se utiliza en la síntesis de aliskiren (el ingrediente activo de Tekturna1) (Esquema\(\PageIndex{24}\)). El paso clave para la síntesis requiere la hidrogenación del derivado del ácido cinámico en presencia de Rh-fosforamidita. La reducción también proporciona 97% ee usando Rh-Walphos.
6.1.7 Reducción de nitrilos α, β-insaturados
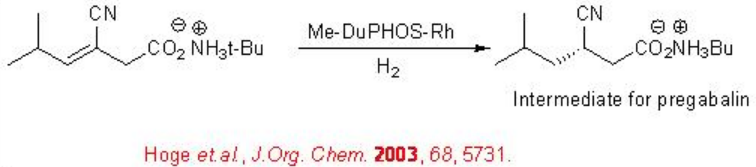
La reducción asimétrica de nitrilos insaturados es un proceso muy útil para la síntesis de muchos intermedios farmacéuticos. Una aplicación importante de esta estrategia implica la reducción adicional del grupo nitrilo para producir aminas quirales. Por ejemplo, la Rh-fosfina quiral cataliza la hidrogenación asimétrica de un nitrilo insaturado (Esquema\(\PageIndex{25}\)). El producto reducido se utiliza para la síntesis de la Pregabalina.
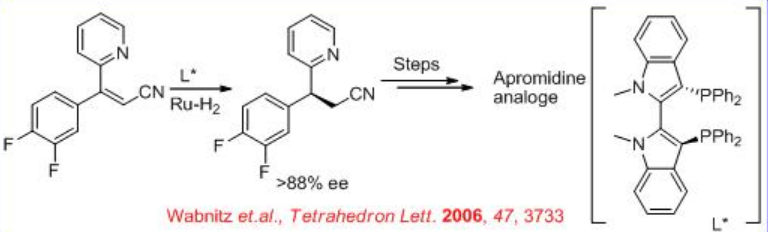
Un ejemplo más desafiante de una reducción de nitrilo insaturado que carece del grupo funcional carboxilato es la reducción asimétrica del nitrilo que se muestra en el Esquema\(\PageIndex{26}\). El producto reducido se utiliza para la síntesis de 3,3-diarilpropilamina quiral, que es un intermedio para la síntesis de las Arpromidinas. Los análogos de arpromidinas son los agonistas más potentes del receptor H 2 de histamina conocidos y prometen vasodilatadores inotrópicos positivos para el tratamiento de la insuficiencia cardíaca congestiva grave.
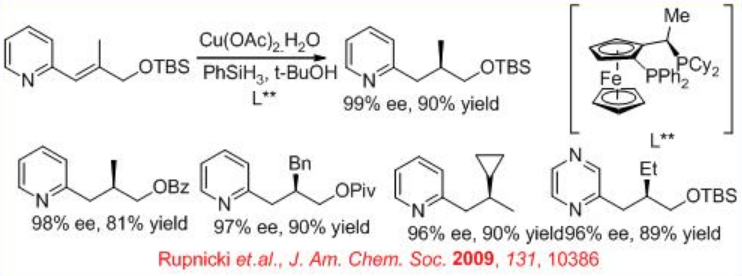
Paralelamente a los sistemas catalíticos basados en Ru, Rh e IR, se ha demostrado catálisis quiral de hidruro de cobre para 1,4-reducciones enantioselectivas de 2-alquenil heteroarenos. Tanto los azoles como las azinas sirven como grupos activadores eficientes para este proceso (Esquema\(\PageIndex{27}\)).