6.2: Reacciones de Cetonas
- Page ID
- 73386
La reducción enantioselectiva del doble enlace C=O en la síntesis orgánica tiene una aplicación importante en la síntesis de muchos productos naturales así como productos farmacéuticos. La conferencia abarca los ejemplos representativos de reacciones catalizadas por metales. Las reacciones con CBS y enzimas están cubiertas en los otros módulos de este curso. Los ligandos quirales de uso frecuente para las reacciones de reducción enantioselectiva catalizadas por metales de cetonas se enumeran en el Esquema\(\PageIndex{1}\).
6.2.1 Reacciones de α-keto amidas
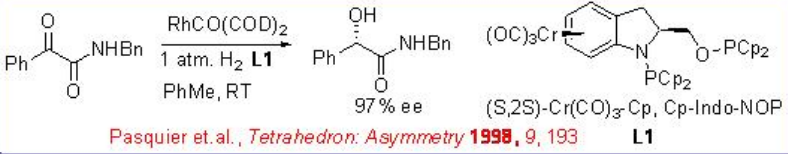
La hidrogenación asimétrica de α-keto ésteres se ha estudiado con varios catalizadores de rodio. Los catalizadores de rodio neutro con ligandos quirales como Cr (CO) 3-Cp, Cp-Indo-NOP demuestran una excelente enantioselectividad y reactividad en la hidrogenación de amidas (Esquema\(\PageIndex{2}\)).
6.2.2 Reacciones de β - Keto Ésteres
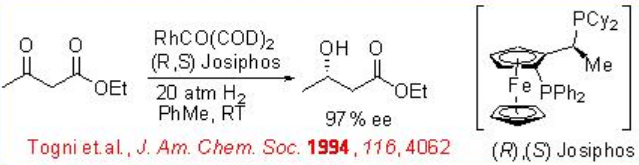
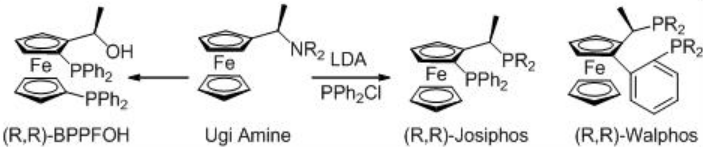
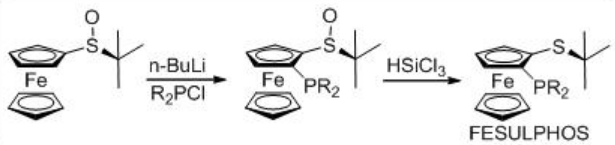
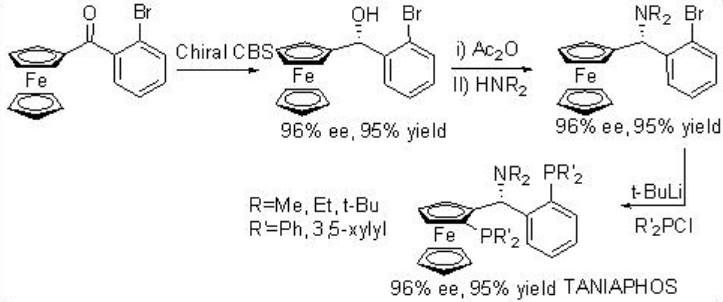
La hidrogenación asimétrica de β-ceto-ésteres ha sido ampliamente estudiada utilizando catalizadores quirales de rutenio. Sin embargo, solo se exploran algunos ejemplos análogos a la reacción catalizada por rodio (Esquema 3). El complejo Rh- (R, S) -Josiphos proporciona un catalizador efectivo para la hidrogenación asimétrica de 3-oxobutanoato de etilo proporcionando el correspondiente β -hidroxi éster en 97% ee. Los ligandos anteriores de la familia Josiphos tales como los ligandos quirales Walphos, Joshiphos, BPPFOH, TRAP y PIGIPHOS podrían sintetizarse fácilmente a partir de amina Ugi comercialmente disponible (Esquema\(\PageIndex{4}\) -\(\PageIndex{6}\)).
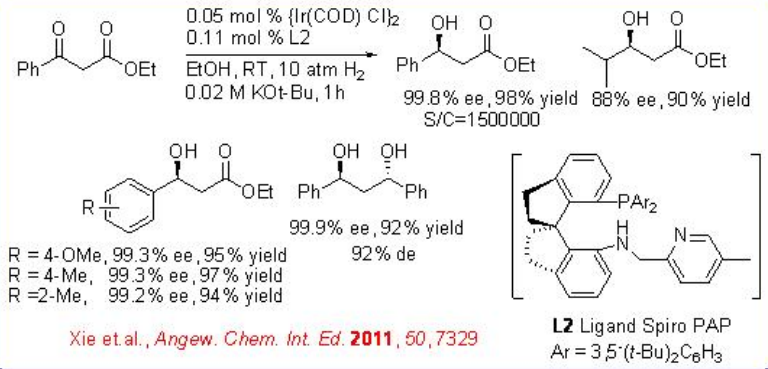
El iridio/espiro PAP se ha utilizado como catalizador efectivo para la hidrogenación asimétrica de β-aril-β-cetoésteres (Esquema\(\PageIndex{7}\)). La reacción proporciona un método fácilmente accesible para la síntesis de β-hidroxiésteres en alta enantioselectividad hasta 99.8% ee y toneladas altas hasta 1230000.
6.2.3 Reacciones de Cetonas Aromáticas
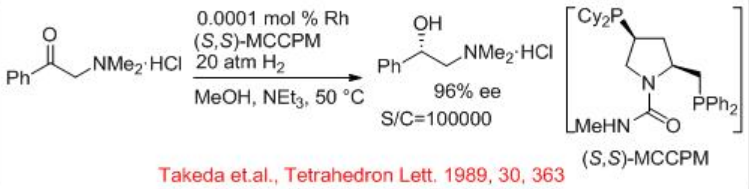
Las amino cetonas y sus sales hidrocloruro pueden hidrogenarse eficazmente con catalizadores quirales de rodio (Esquema\(\PageIndex{8}\)). Los precatalizadores de rodio, combinados con ligandos de fósforo quirales (S, S) - MCCPM proporcionan una excelente enantioselectividad y reactividad para la hidrogenación asimétrica de sales clorhidrato de α, β y γ -alquil amino cetona con S/C=100000.
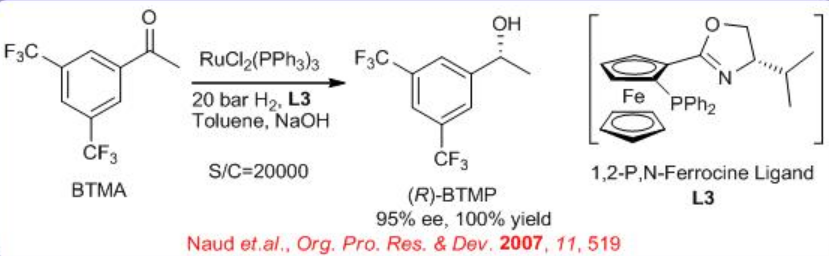
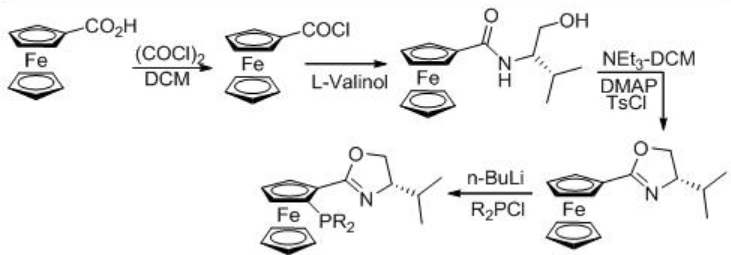
La hidrogenación enantioselectiva de 3,5-bistrifluorometil acetofenona (BTMA) se puede llevar a cabo utilizando un complejo RU/fosfina-oxazolina (Esquema\(\PageIndex{9}\)). La reacción es compatible con escala de 140 kg a 20 bar y 25 °C con relaciones S/C de 20,000. La síntesis del ligando se muestra en el Esquema\(\PageIndex{10}\).
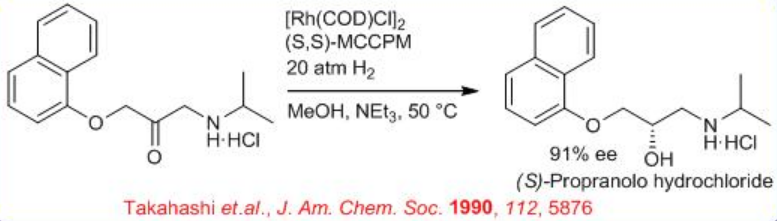
La hidrogenación enantioselectiva de amino cetonas se ha aplicado extensivamente a la síntesis de fármacos quirales y farmacéuticos (Esquema\(\PageIndex{11}\)). Por ejemplo, la hidrogenación enantioselectiva directa de 3-ariloxi-2-oxo-1-propilamina conduce a 1-amino-3-ariloxi-2-propanol usando 0.01 mol% del complejo neutro Rh- (S, S) -MCCPM. El producto quiral 1-amino-3-ariloxi-2-propanol sirve como agentes bloqueantes β-adrenérgicos. El (S) -Propranolol se obtiene en 90.8% ee de la α-amino cetona correspondiente.
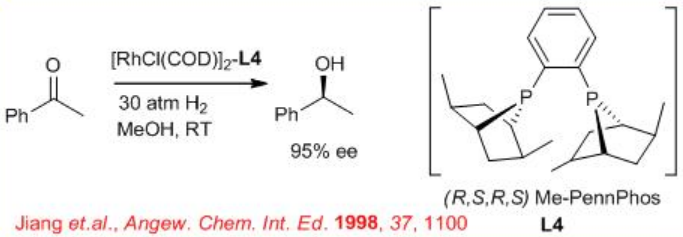
6.2.4 Reacciones de cetonas alifáticas
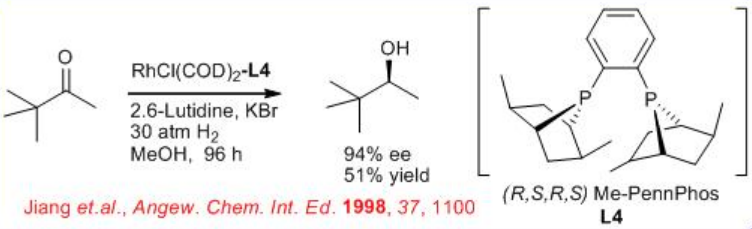
La hidrogenación asimétrica de cetonas alifáticas simples sigue siendo un problema desafiante. Esto se debe a la dificultad de diseñar el catalizador quiral apropiado que diferencie fácilmente entre los sustituyentes de dos alquilo de la cetona. Se han obtenido resultados prometedores en la hidrogenación asimétrica de cetonas alifáticas utilizando el complejo (R, S, R, S) -PennPhos- Rh en combinación con 2,6-lutidina y KBr. Por ejemplo, la reacción de terc - butil metil cetona se lleva a cabo con 94% ee. De igual manera, las isopropil-, n-butil - y ciclohexil metil cetonas pueden reducirse con 85% ee, 75% ee y 92% ee, respectivamente.
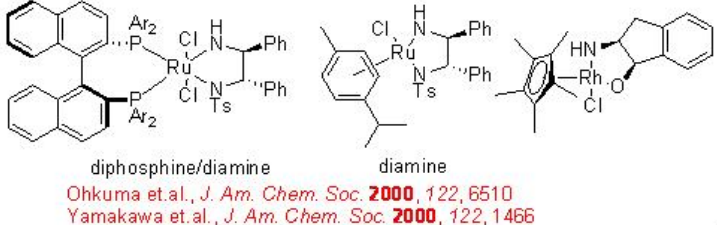
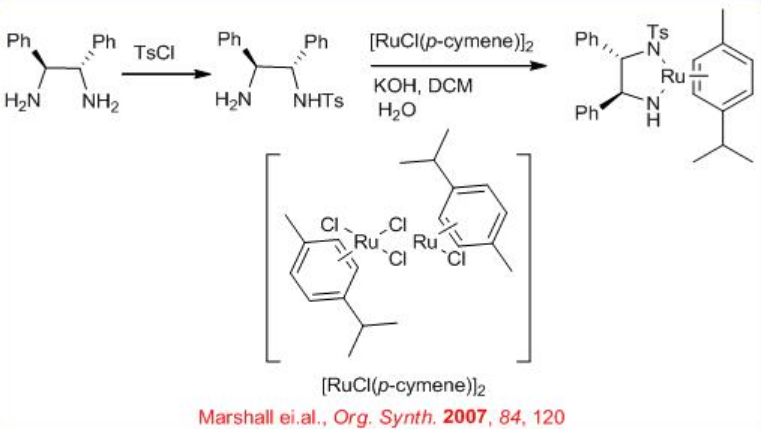
La Ru-difosfina/diamina quiral derivada de BINAP quiral, DPEN (difeniletilendiamina) e indanol efectúan hidrogenación enantioselectiva de ciertas amino o amido cetonas mediante un mecanismo no quelato sin interacción entre Ru y nitrógeno u oxígeno (Esquema\(\PageIndex{14}\)). El catalizador de diamina se puede sintetizar a partir de 1,2-difeniletilendiamina quiral (Esquema\(\PageIndex{15}\)).
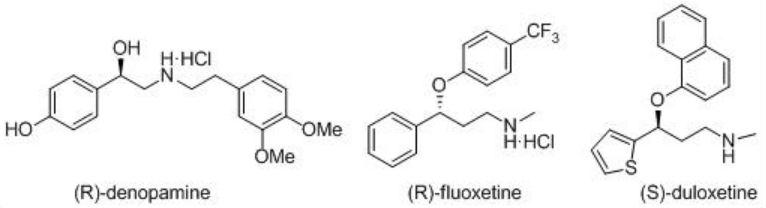
Estos catalizadores han sido empleados para la síntesis asimétrica de diversos fármacos importantes, incluyendo (R) -denopamina, un agonista del receptor β 1, el antidepresivo (R) -fluoxetina, el antipsicótico BMS 181100 y (S) - duloxetina (Esquema\(\PageIndex{16}\)).
Las benzofenonas asimétricas también podrían hidrogenarse con una alta relación S/C de hasta 20000 sin sobre-reducción (Esquema\(\PageIndex{17}\)). La hidrogenación enantioselectiva de ciertas benzofenonas orto-sustituidas conduce a los benzhidros asimétricamente sustituidos, permitiendo la síntesis conveniente de los anti- colinérgicos y anti -histamínicos (S) -orfenadrina y antihistamínicos (R) -neobenodina.
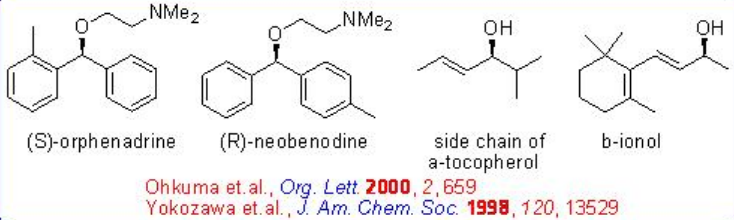
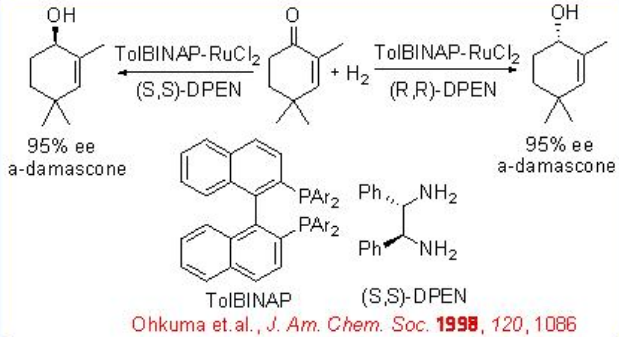
La hidrogenación asimétrica de la cetona simple generalmente se logra mediante el uso combinado de una (S) -BINAP y una (S) -1,2-difeniletilendiamina. Sin embargo, la reacción de 2,4,4-trimetil-2-ciclohexenona se puede hacer efectivamente con RuCl 2 racémico [-Tol-BinAP] - y DPEN quiral con hasta > 95% ee (Esquema\(\PageIndex{18}\)).