8.1: Hidrosililación de Alquenos
- Page ID
- 73170
La hidrosililación asimétrica y la hidroboración de dobles enlaces carbono-carbono seguida de la escisión oxidativa de los enlaces C-Si y C-B dan métodos efectivos para la construcción de alcoholes ópticamente activos (Esquema\(\PageIndex{1}\)).
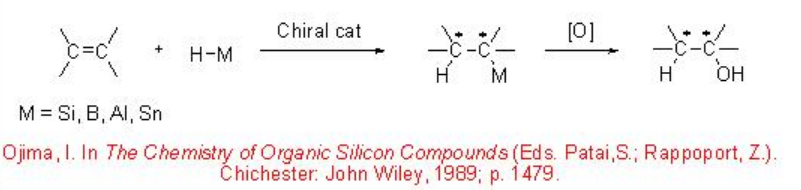
La hidrosililación asimétrica de sustratos insaturados carbono-carbono proporciona métodos efectivos para la síntesis de organosilanos ópticamente activos, los cuales son intermedios versátiles en la síntesis orgánica. Los alquil y aril silanos quirales se pueden convertir en alcoholes ópticamente activos con configuración de retención mediante escisión oxidativa de un enlace carbono-silicio en enlace carbono-oxígeno, mientras que la reacción diastereoselectiva de alilo y alenilsilanos quirales con enlace C=O puede dar homoalílico y homopropargílico alcoholes.
8.1.1 Reacciones del estireno y sus derivados
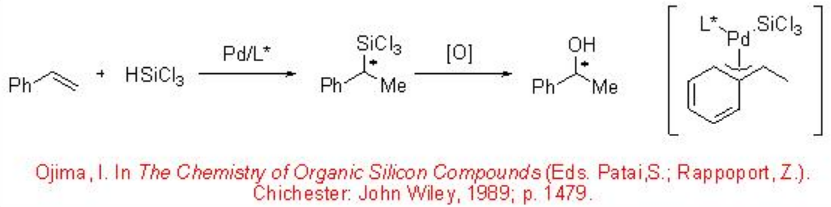
La hidrosililación asimétrica quiral catalizada por paladio de estireno con triclorosilano ha sido ampliamente estudiada. La reacción procede con excelente regioselectividad para dar 1-fenil-1-sililetano a través de un intermedio estable de π- bencil paladio (Esquema\(\PageIndex{2}\)).
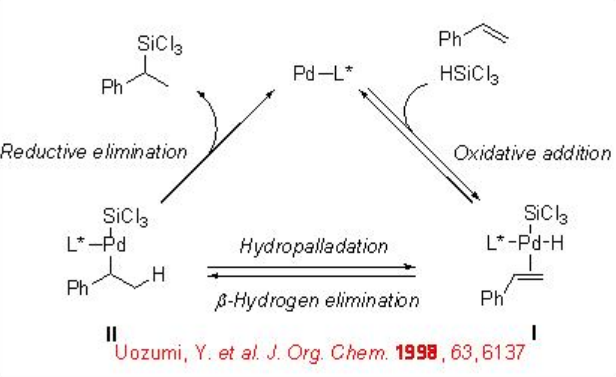
Esquema\(\PageIndex{3}\) ilustra el mecanismo posible. Los estudios de marcaje con deuterio sugieren que la eliminación de hidrógeno β es mucho más rápida en comparación con la eliminación reductiva del intermedio II. La implicación de la hidropaladación en el ciclo catalítico ha sido revelada por el análisis de producto secundario de la reacción de o-alilestireno.
La reacción ha sido utilizada en la síntesis de 1-aril-1,2-dioles a partir de arilacetilenos (Esquema\(\PageIndex{4}\)). La hidrosililación catalizada por platino de arilacetileno da (E) -1-aril-2- (triclorosilil) etanos que podrían hacerse reaccionar adicionalmente con triclorosilano en presencia de complejo de paladio quiral para proporcionar 1-aril-1,2-bis (triclorosilil) etanos ópticamente activos. Este último podría transformarse en 1,2-diol ópticamente activo a través de la escisión oxidativa del enlace carbono-silicio en enlace carbono-oxígeno.
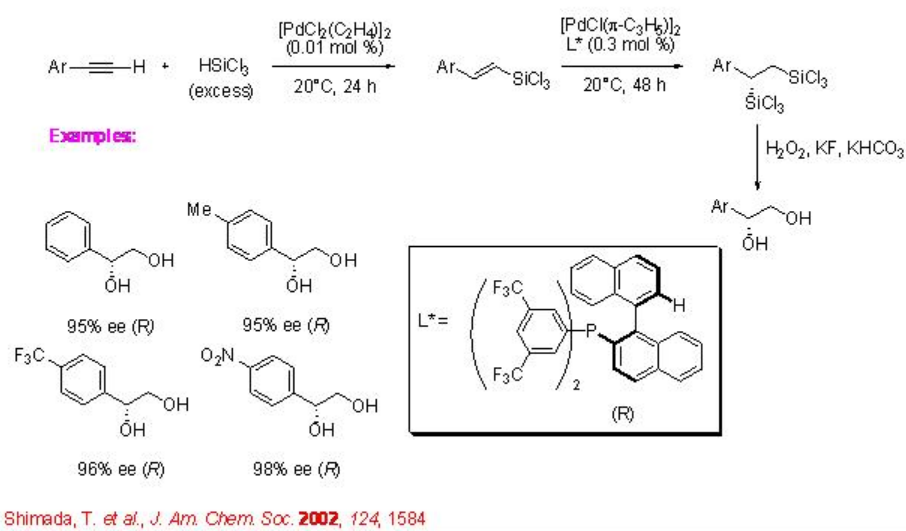
También se han empleado otros catalizadores quirales para la hidrosililación asimétrica de alquenos. El complejo quiral bis (oxazolinil) fenilrodio cataliza la hidrosililación asimétrica de estirenos con hidro (alcoxi) silanos en alta enantioselectividad, aunque se encuentra que la regioselectividad es algo moderada (Esquema\(\PageIndex{5}\)).
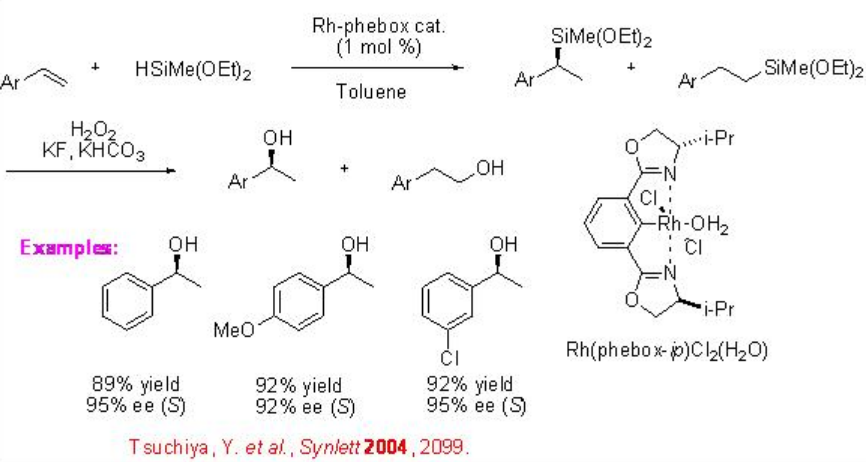
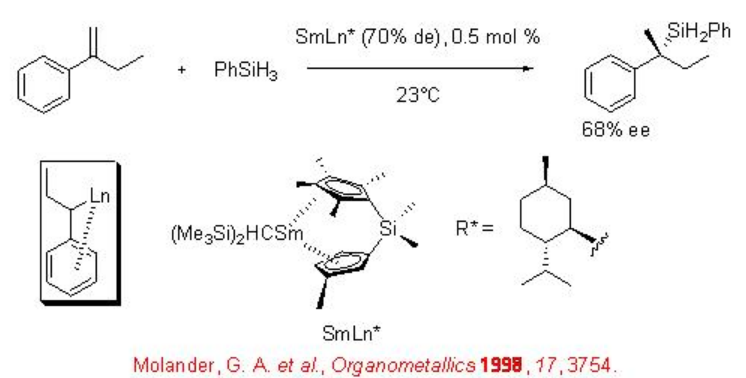
Los estirenos α - sustituidos proceden a la reacción con fenilsilano para proporcionar terc - alquilsilanos bencílicos en presencia de organolantanido quiral como catalizador en enantioselectividad moderada (Esquema\(\PageIndex{6}\)).
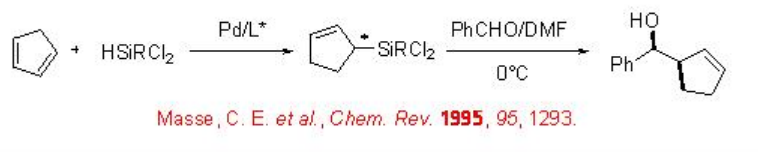
8.1.2 Reacciones de 1,3-Dienos
La reacción de 1,3-dienos con hidrosilanos que tienen grupos aceptores de electrones sobre silicio proporciona silanos ópticamente activos sintéticamente útiles en presencia de complejo quiral de paladio (Esquema\(\PageIndex{7}\)). La reacción procede de una manera 1,4 proporcionando alilsilanos quirales que podrían convertirse en alcoholes homoalílicos en la reacción con aldehídos.
Se ha demostrado el uso de ligandos ferrocenilfosfina y mop-phen para la hidrosililación de ciclo-1,3-hexadieno en presencia de sales de paladio (Esquema\(\PageIndex{8}\)). La reacción con fenildifluorosilano proporcionó la mayor enantioselectividad en comparación con la del triclorsilano o metildiclorosilano. Con base en la reacción con silano marcado con deuterio, se ha propuesto la implicación del intermedio π-alilpaladio y la adición de 1,4- cis.
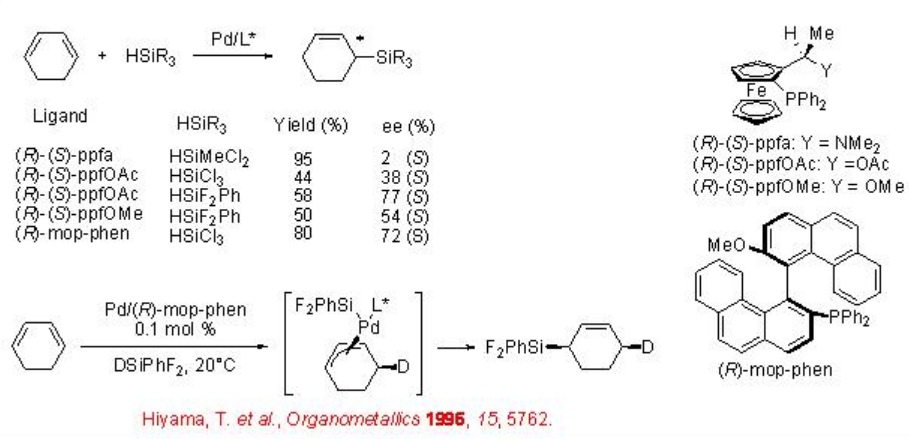
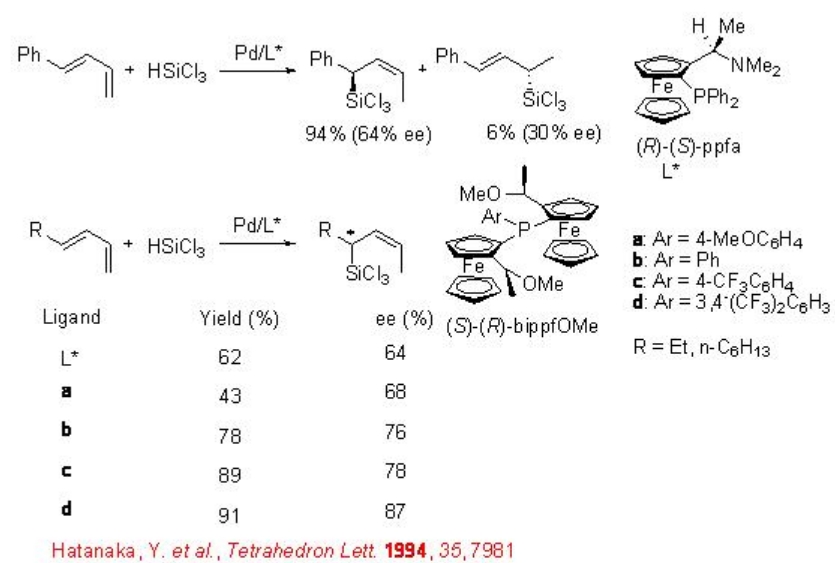
En el caso de los 1,3-dienos lineales, la regioselectividad se ha convertido en un problema. En la reacción de 1-fenil-1,3-butadieno usando ligando ferrocenilo, (R) - (S) -ppfa, se observa la formación de una mezcla de alilsilanos regioisoméricos (Esquema\(\PageIndex{9}\)). Sin embargo, en la reacción de 1,3-dienos sustituidos con alquilo, 1,3-hexadieno y 1,3-decadieno, se obtiene un único regioisómero con enantioselectividad moderada. Se observa una mejora en la enantioselectividad empleando los ligandos bis (ferrocenil) monofofina a-d que tienen dos restos ferrocenilo quirales planos sobre el átomo de fósforo.
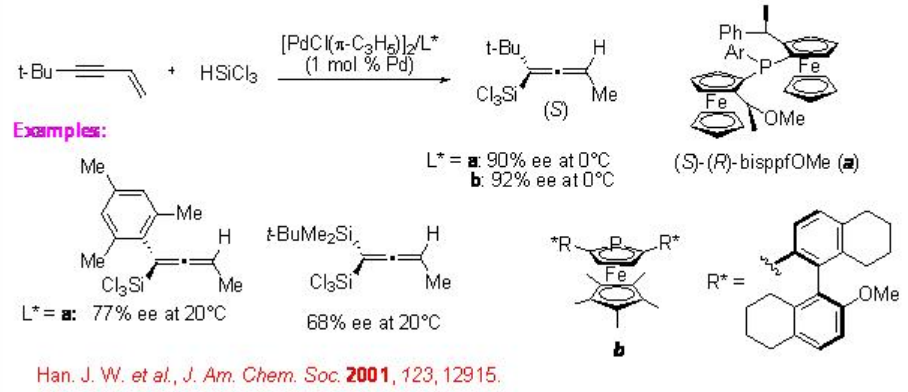
La reacción de 1-buten-3-inos sustituidos con grupos voluminosos en el extremo alquino proporciona alenilsilanos enantioméricamente enriquecidos en presencia de complejo de paladio (Esquema\(\PageIndex{10}\)). Por ejemplo, la reacción de 5,5-dimetil-1-hexen-3-ino usando (S) - (R) -bisPFOMa procede de una manera 1,4-para dar alenilo (tricloro) silanos en alta regio- y enantioselectividad. Se muestra una potenciación adicional en la enantioselectividad empleando fosfametaloceno quiral b que tiene un resto η 5-C 5 Me 5 estéricamente exigente.
8.1.3 Reacciones de alquenos sustituidos con alquilo
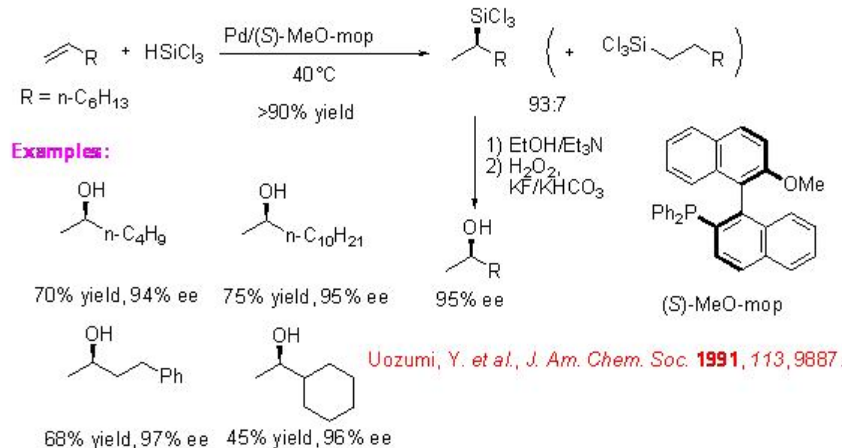
La hidrosililación de alquenos terminales simples da productos ramificados con alta regioselectividad. Los sistemas de paladio muestran un sistema catalítico excepcional en comparación con los sistemas basados en Pt, Ni y Rh. Por ejemplo, la hidrosililación de 1-octeno con triclorosilano usando paladio- (S) -MeO-MOP da una mezcla 93:7 de 1-octilsilano y 2-octilsilano con 95% ee (Esquema\(\PageIndex{11}\)).
El sistema catalítico anterior también es efectivo para la hidrosililación de alquenos cíclicos, tales como norborneno y biciclo [2.2.2] octano, 2,5-dihidrofurano y norbornadieno. Por ejemplo, la reacción del norborneno da aducto exo exclusivamente (Esquema\(\PageIndex{12}\)). El producto hidrosililado puede transformarse en exo -2-norbornanol o endo -2-bromonorbornano a través del pentafluorosilicato correspondiente. Además, las ferrocenilmonofosfinas quirales a-d son demasiado efectivas para este proceso con excelente enantioselectividad.
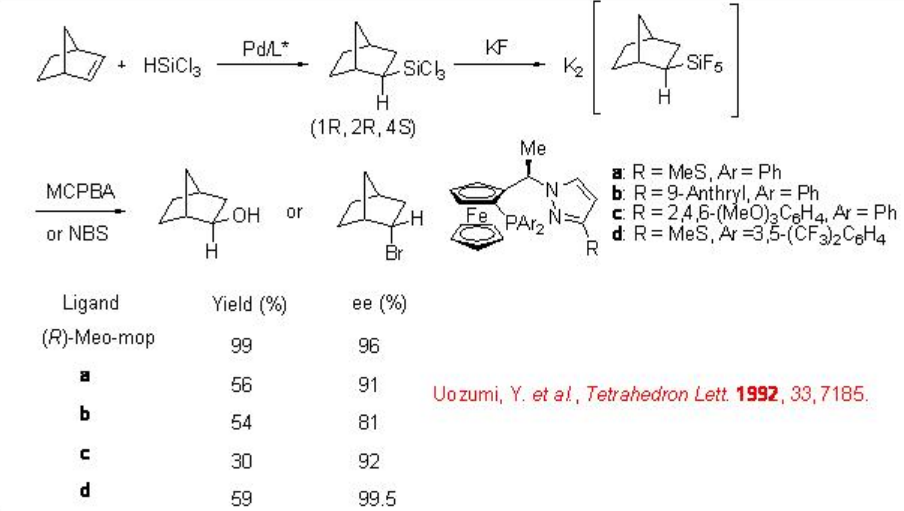
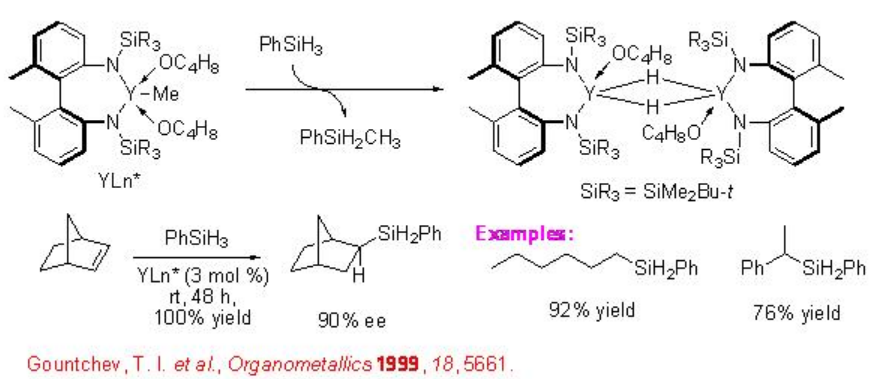
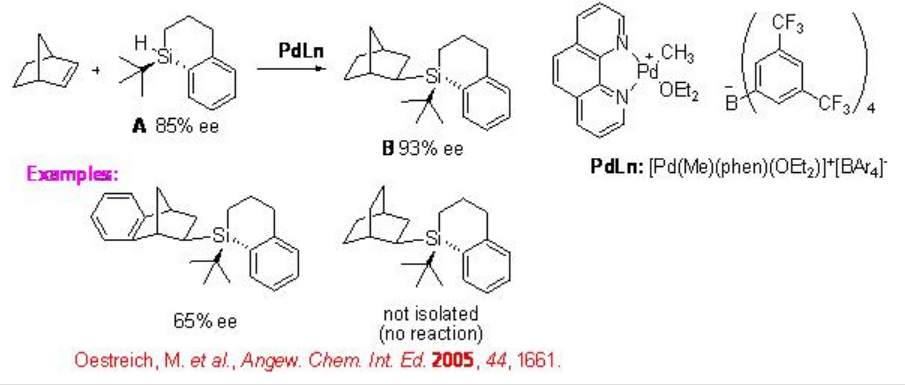
El complejo quiral de hidruro de itrio (complejo metálico d 0) que porta ligando no CP cataliza la hidrosililación de norborneno con fenilsilano para producir aducto exo con 90% ee (Esquema\(\PageIndex{13}\)). Más recientemente, se reporta la primera transferencia de quiralidad de silicio a carbono en una reacción controlada por reactivo de norborneno en presencia de complejo de paladio aquiral. Se encuentra que la hidrosililación de norborneno con silano quiral A que tiene 85% ee forma el producto hidrosililado B con 93% ee exhibiendo amplificación asimétrica (Esquema\(\PageIndex{14}\)).
8.1.4 Hidrosililación intramolecular
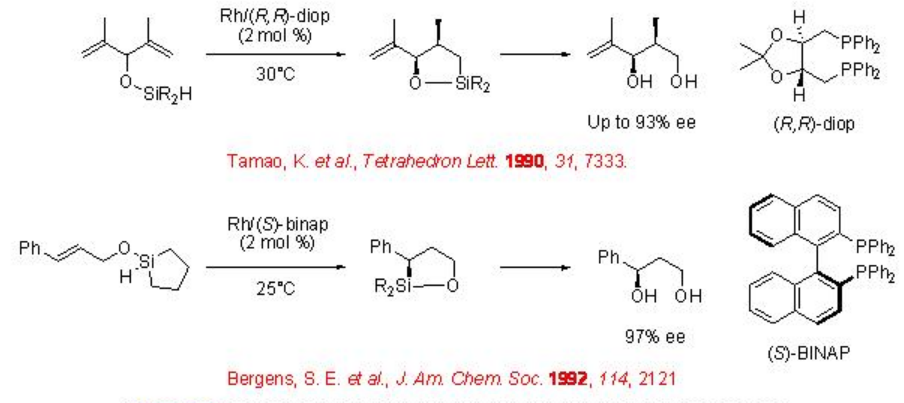
La síntesis de polioles ópticamente activos a partir de alcoholes alílicos se puede lograr usando hidrosililación intramolecular quiral catalizada por RH seguida de oxidación de aliloxi hidrosilanos (Esquema\(\PageIndex{15}\)). Por ejemplo, el hidrosilil éter de di (2-propenil) metanol se puede convertir en 1,3-diol ópticamente activo usando hidrosililación intramolecular en presencia de rodio- (R, R) -diop quiral seguido de oxidación. También se encontró que el rh-BinAP es un catalizador eficaz para la hidrosililación intramolecular de éteres de hidrosililo de alcoholes alílicos.
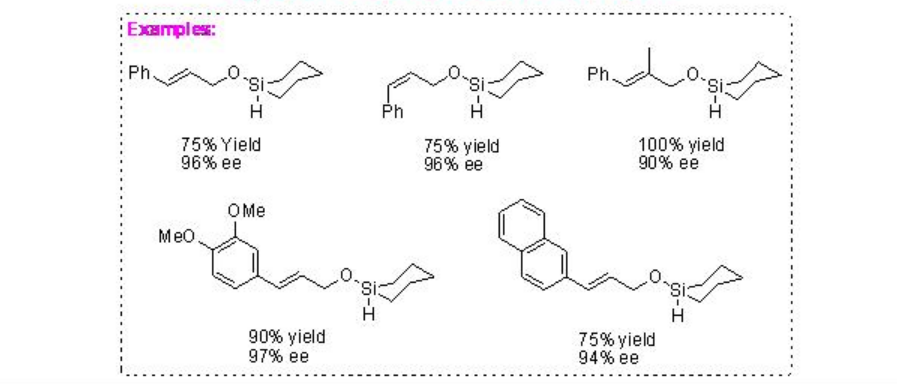
8.1.5 Ciclización/Hidrosililación
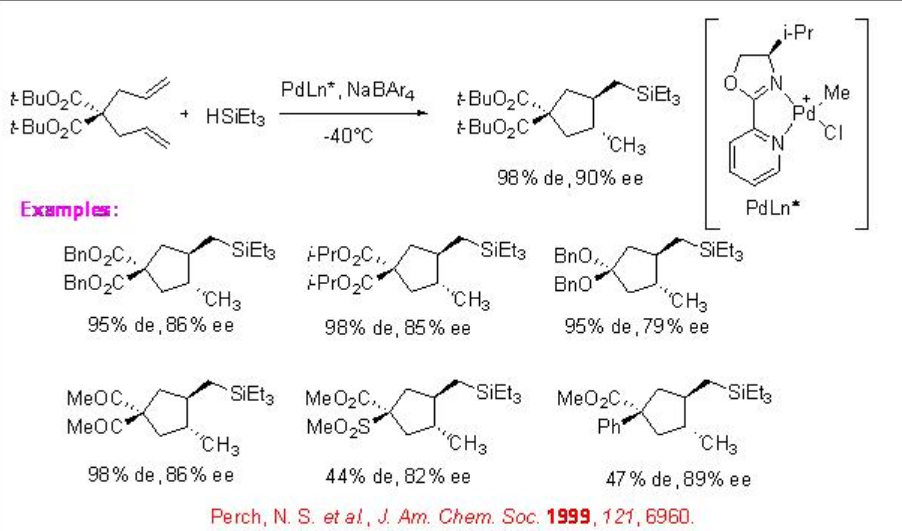
La ciclación asimétrica y la hidrosililación de compuestos a, ω-diinsaturados como 1,6-dienos y 1,6-eninos proporcionan una poderosa herramienta para la construcción de carbociclos funcionalizados ópticamente activos. Por ejemplo, la reacción en tándem de dialilmalonato en presencia de complejo catiónico de Pd que porta una piridina-oxazolina quiral procede con alta diastereoselectividad para producir el correspondiente ciclopentano trans-sustituido con 90% ee (Esquema\(\PageIndex{16}\)).
Las reacciones de 1,6-diinos usando complejos catiónicos de Rh portadores de bisfosfina quiral dan los alquilidenociclopentanos hidrosililados con alta enantioselectividad. Por ejemplo, el 1,6-enino procede a la reacción con trietilsilano en presencia de Rh catiónico y (R) -bifemp para dar alquilideno ciclopentano hidrosililado en 92% ee (Esquema\(\PageIndex{17}\)). Posteriormente, se encontró que el complejo quiral de Rh que contiene espiro difosfina (R) -sdp es efectivo para este proceso.
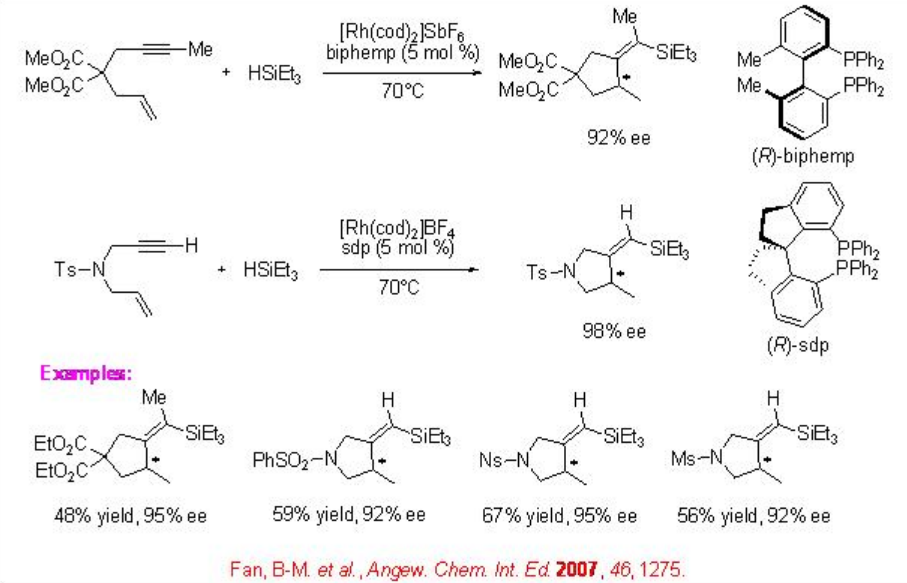
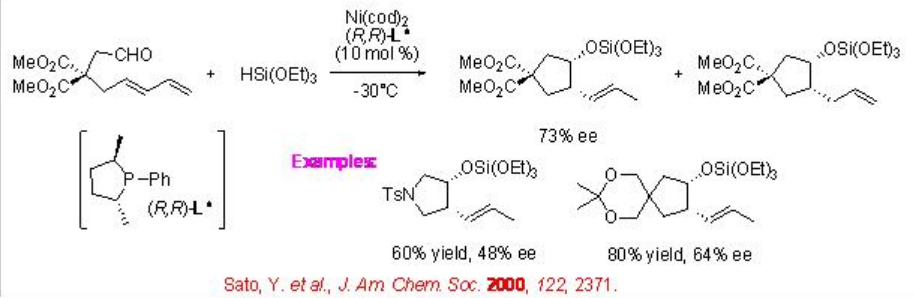
La síntesis de carbociclos también se puede lograr mediante la ciclación de ω-formil-1,3-dienos en presencia de hidrosilanos y complejo quiral de níquel (Esquema\(\PageIndex{18}\)). Por ejemplo, el complejo de níquel cerovalente de (2 R ,5 R) -2,5-dimetil-1-fenilfosfolano cataliza la ciclación de 1,3-dienos con un grupo formilo anclado en presencia de trietoxisilano para dar carbociclo de cinco miembros con 73% ee.