9.1: Reacción de hidroformilación
- Page ID
- 73043
La carbonilación de los sustratos insaturados usando catálisis de metales de transición proporciona una poderosa herramienta para producir intermedios químicos finos. La carbonilación asimétrica se encuentra entre los procesos homogéneos más desafiantes y su potencial aún no se ha logrado. La hidroformilación catalizada por Rh de alquenos junto con el hidroxi catalizado por PD y la alcoxicarboxilación de alquenos son los ejemplos más famosos de las reacciones de carbonilación asimétrica. La diferencia importante entre estas reacciones es que la hidroformilación catalizada por Rh es de mayor interés industrial que el proceso de carbonilación basado en paladio.
La conversión de alquenos a aldehídos es la reacción catalizada por metales de transición homogéneos de mayor volumen. Este proceso ha sido ampliamente explorado y se han desarrollado varios métodos y catalizadores para controlar la regioselectividad en aldehídos internos y terminales (Esquema\(\PageIndex{1}\)).
9.1.1 Reacción de Vinil Arenes
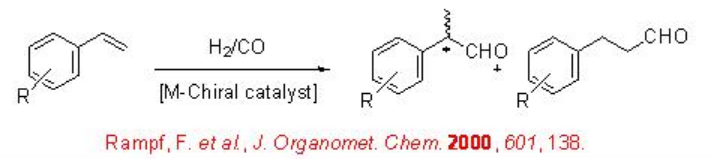
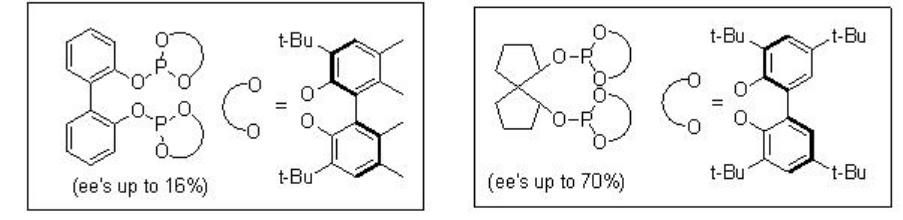
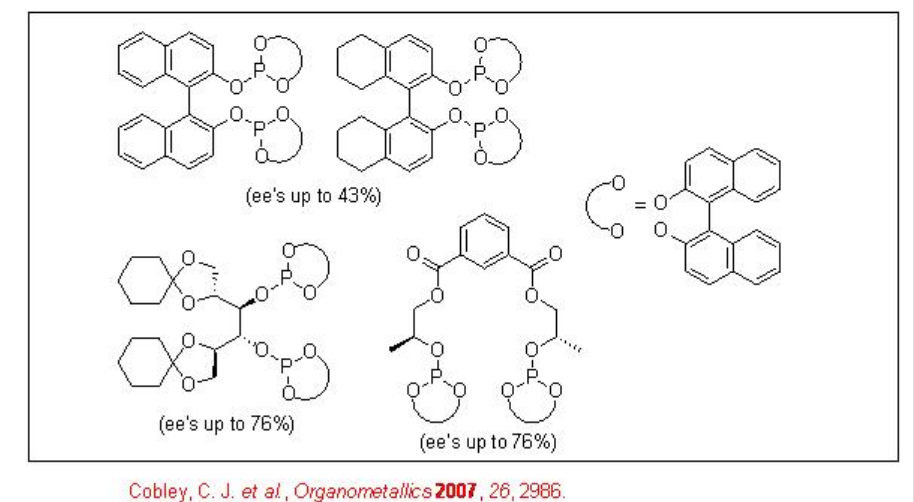
La hidroformilación asimétrica de vinil arenos es una vía atractiva para producir aldehídos ópticamente activos, los cuales son precursores de sustrato para la síntesis de productos farmacéuticos de alto valor, agroquímicos, polímeros biodegradables y cristales líquidos (Esquema\(\PageIndex{2}\)). Desde principios de 1970, los complejos quirales de Rh-difosfina se han utilizado como catalizadores para esta transformación con enantioselectividad moderada (por debajo del 60%). A partir de principios de 1990, el uso de ligandos bisfofacíclicos, difosfitos y fosfina-fosfito, ha surgido como alternativa para esta reacción. Esquema\(\PageIndex{3}\) resume algunos de los nuevos ligandos difosfito desarrollados con cadenas principales biaril, espiro, piranósido, manitol y macrocíclicas para la hidroformilación asimétrica de vinil arenos con éxito bajo a moderado (ee de 16% a 76%).
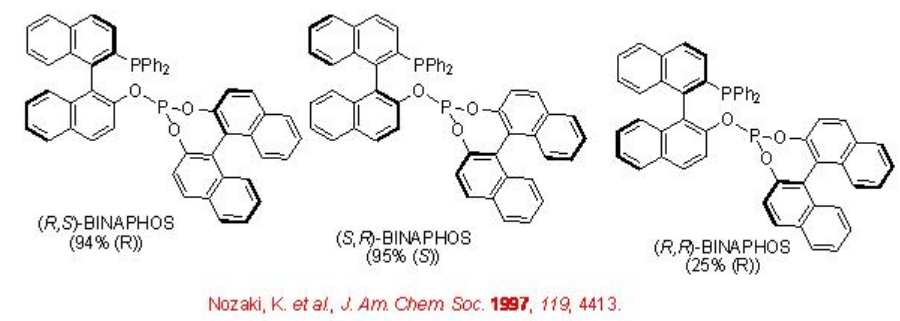
Esquema\(\PageIndex{4}\) resume algunos de los ligandos fosfina-fosfito exitosos para la hidroformilación asimétrica de vinil areno. La enantioselectividad depende de la configuración de ambos restos binaftil. La mejor enantioselectividad se observa cuando las configuraciones de los dos restos binaftil son opuestas.
9.1.2 Reacción del Acetato de Vinilo
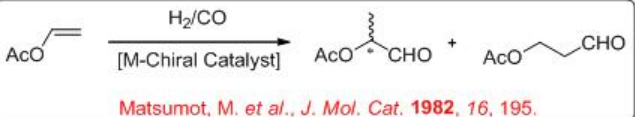
La reacción del acetato de vinilo es más desafiante en comparación con la de los vinilarenos. Este proceso proporciona 2- y 3- acetoxipropanales con alta selectividad (Esquema\(\PageIndex{5}\)). Como subproductos se producen acetato de etilo y ácido acético.
El esquema\(\PageIndex{6}\) ilustra algunos de los ligandos exitosos para la hidroformilación catalizada por Rh de acetato de vinilo. La enantioselectividad de las reacciones se muestra entre paréntesis.
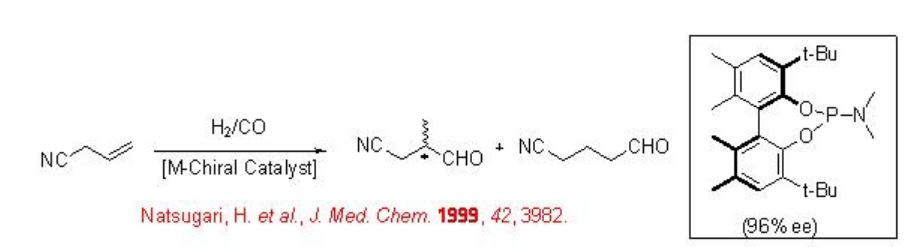
9.1.3 Reacción de Cianuro de Alilo
La hidroformilación asimétrica del cianuro de alilo es de gran interés debido a que el derivado isoaldehído se puede convertir en 2-metil-4-butanol, el cual es intermedio, para la síntesis asimétrica de la taquiquinina, un nuevo agonista del receptor NK1 (Esquema\(\PageIndex{7}\)). La reacción ha sido estudiada utilizando ligandos difosfito, fosfina-fosfito, bis-fosfacíclicos y fosforoamidita con hasta 96% ee.
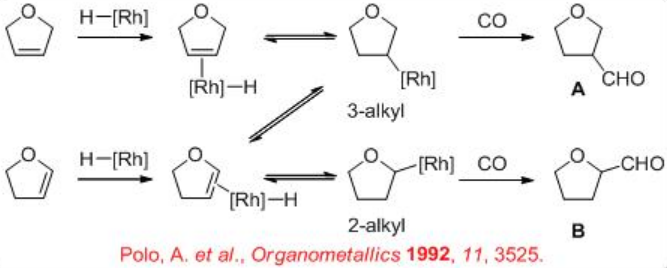
9.1.4 Reacción de alquenos heterocíclicos
Pocos estudios se enfocan en la hidroformilación de alquenos heterocíclicos. Para estos sustratos, la regioselectividad es de especial interés porque es diferente a la de los alquenos acíclicos. Por ejemplo, la hidroformilación de 2,5-dihidrofurano puede conducir a la formación tanto del tetrahidrofurano-3-carbaldehído A (producto esperado) como del tetrahidrofurano-2-carbaldehído B (podría formarse mediante un proceso de isomerización). La regioselectividad debe ser controlada por la modificación de los ligandos y las condiciones de reacción.
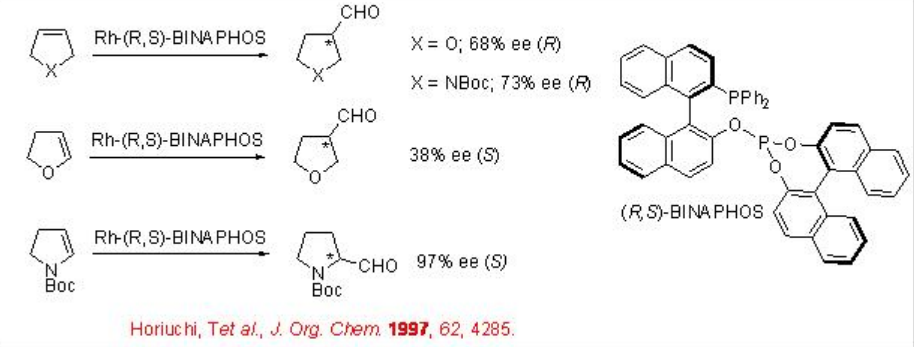
Esquema\(\PageIndex{9}\) resume la reacción de 2,5-dihidrofurano, derivado de 3-pirrolina y derivado de 4,7-didiro-1,3-dioxepina usando complejo Rh quiral que lleva R, S-BINAPHOS. Los aldehídos ópticamente activos se obtienen como productos individuales con enantioselectividades entre 64-97%. En el caso del 2,5-dihidrofurano, se observa hasta 64% de regioselectividad para la formación de tetrahidrofurano-3-carbaldehído A, mientras que la reacción de 2,3-dihidrofurano condujo a la formación de una mezcla de A y B (1:1) con un ee de 38% en A.
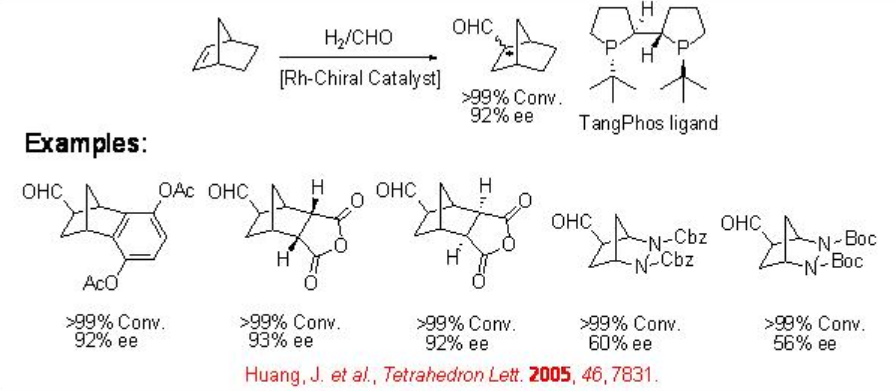
9.1.5 Reacción de Alke bicíclico nes
La hidroformilación asimétrica de alquenos bicíclicos ha recibido poca atención. Esta reacción es interesante debido a las siguientes características: (i) la reacción puede conducir a la formación de tres centros quirales sobre la formación de un enlace C-C; (ii) no hay problema de regioselectividad; (iii) los grupos funcionales ubicados opuestos al doble enlace carbono-carbono podrían ser versátiles. Esquema\(\PageIndex{10}\) resume algunos de los ejemplos para la hidroformilación asimétrica de alquenos bicíclicos empleando Rh-tangphos.