9.2: Alcoxicarbonilación asimétrica y reacciones relacionadas
- Page ID
- 73060
Reacción de los vinilarenos
Desde el punto de vista académico e industrial, las reacciones de hidroxi y alcoxicarbonilación asimétricas catalizadas por PD son procesos atractivos. Sin embargo, son menos exitosos en comparación con las reacciones de hidroformilación catalizadas por Rh. Esto se debe a la dificultad de obtener simultáneamente regio- y enantioselectividades altas.
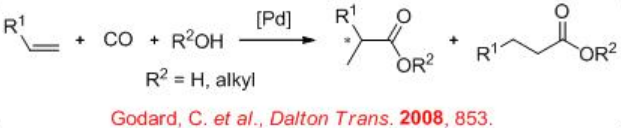
La alcoxicarbonilación de los vinilarenos es un proceso importante y los productos resultantes (ácidos 2-arilpropanoicos y derivados) sirven como precursores de sustrato para fármacos antiinflamatorios no esteroideos, particularmente ibuprofeno y naproxeno (Esquema\(\PageIndex{1}\)).
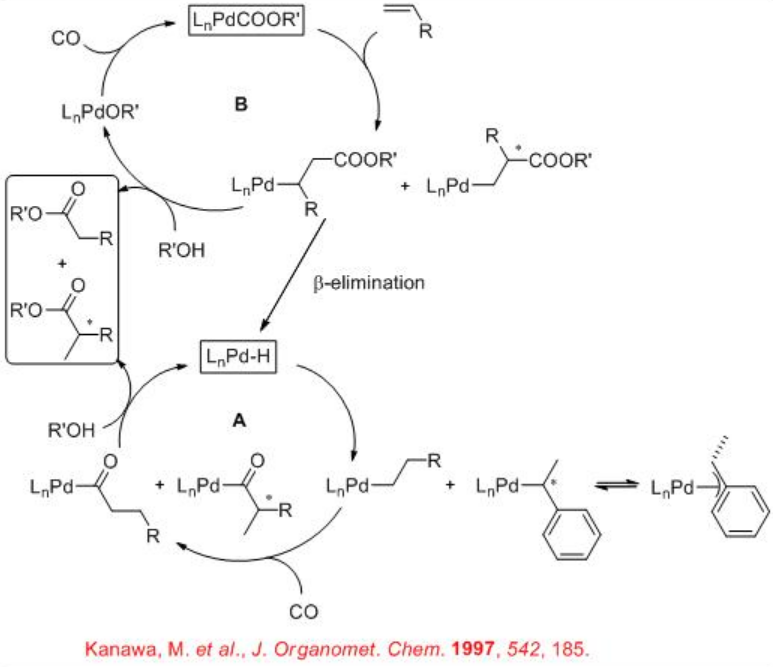
Se ha sugerido la coexistencia de dos ciclos catalíticos para la reacción de alcoxicarbonilación (Esquema\(\PageIndex{2}\)). En el ciclo A del complejo hidrido-paladio, la inserción del alqueno en el enlace Pd-H puede dar un complejo de alquilpaladio que podría reaccionar con CO vía coordinación e inserción migratoria para producir el complejo Pd-acilo. La alcohólisis del complejo PD-acilo puede regenerar las especies de Pd-H y producir el éster. En el ciclo alcoxicarbonilo B, el alqueno se inserta en el enlace paladio-carbono del complejo alcoxicarbonil-paladio y el producto resultante en la alcohólisis da un complejo alcoxi-paladio y el éster. El complejo alcoxi-paladio reacciona entonces con CO vía coordinación e inserción migratoria para regenerar el complejo alcoxicarbonil-paladio. La formación de la especie Pd-H también puede tener lugar a partir de los complejos formados en el ciclo catalítico B vía β -eliminación de un éster insaturado después de la inserción del alqueno. En el caso del vinilareno, el intermedio alquilo ramificado podría estabilizarse a través de la formación de especies π -bencílicas.
En caso de síntesis asimétrica, la regioselectividad de estas reacciones es de importancia crítica debido a que los productos ramificados solo contienen el centro quiral. La Figura\(\PageIndex{1}\) resume algunos de los ligandos de difosfina utilizados para la hidroxi- y alcoxicarbonilación catalizada por paladio de vinilarenos. Aunque se encuentra que la enantioselectividad es moderada a buena (hasta 98%), en la mayoría de los métodos se encuentra que la regioselectividad es baja.
También se han estudiado ligandos bidentados de piridina-fosfina para la etoxicarbonilación asimétrica catalizada por paladio de estireno (Figura\(\PageIndex{2}\)). La regioselectividad de los productos ramificados es buena pero la enantioselectividad se encuentra baja (l/b = lineal/ramificada).
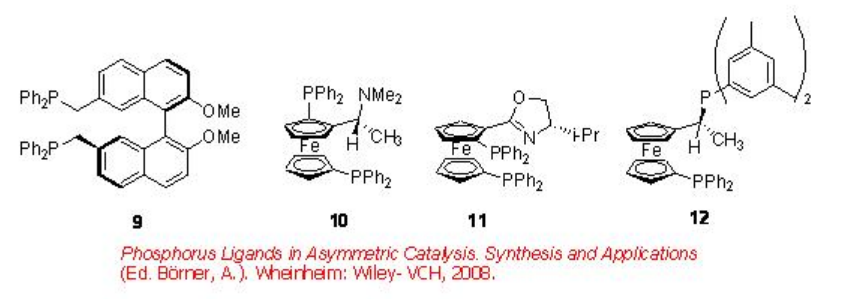
La figura\(\PageIndex{3}\) resume los ligandos monodentados selectivos estudiados para la metoxicarbonilación asimétrica catalizada por paladio de vinailarenos. Se encontró que el ligando 18 es efectivo para la hidroxicarbonilación de 2-vinil-6-metoxinaftaleno bajo 1 atm de una mezcla de CO y O2 en presencia de PdCl 2-CuCl 2 a temperatura ambiente proporcionando el producto objetivo con 91% ee y 100% regioselectividad.
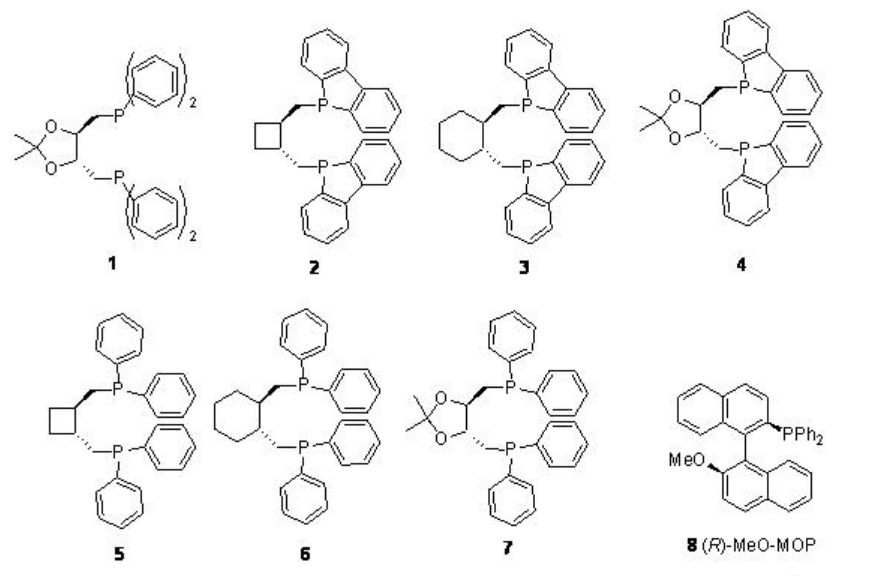
Figura\(\PageIndex{1}\): Ligandos de Difosfina utilizados en la Hidroxi-y Alcoxicarbonilación Asimétrica de Vinilarenos.
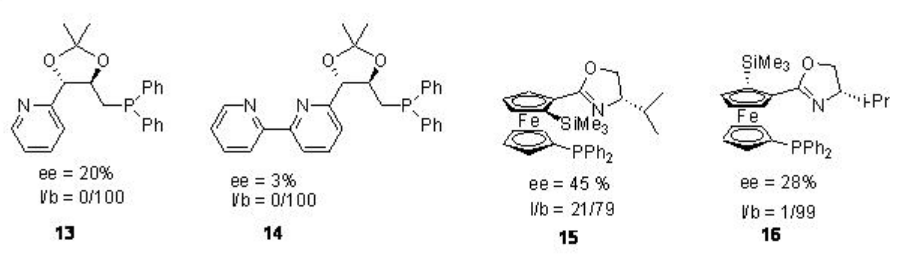
Figura\(\PageIndex{2}\): Ligandos P-N utilizados para las reacciones de alcoxicarbonilación.
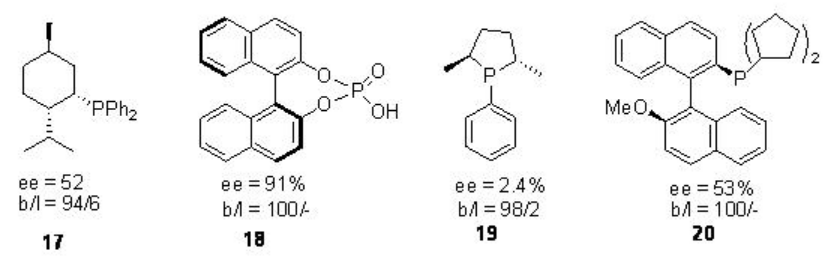
Figura\(\PageIndex{3}\): Ligandos de fosfina monodentados utilizados para la metoxcarbonilación de vinilarenos.
9.2.2 Reacción de Otro Sustrato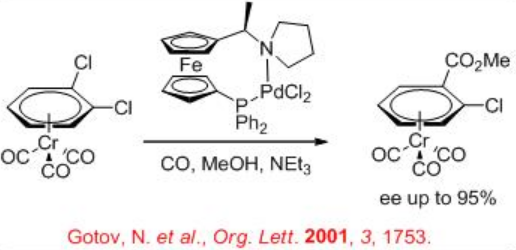
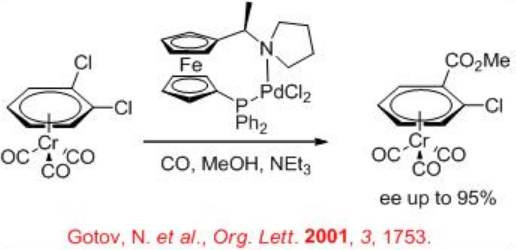
La metoxicarbonilación de 1,2-diclorobenceno-CR (CO) 3 ha sido estudiada utilizando complejo de paladio con sistema quiral ferrocenil (R, S) -PPF-pirrolidina para introducir quiralidad plana en complejos p (Esquema\(\PageIndex{3}\)). La reacción proporciona hasta 95% ee en presencia de 1 atm de CO a 60°C en presencia de trietilamina.
Bis-alcoxicarbonilación de vinilarenos
Los derivados del ácido butanodioico ópticamente activos son compuestos de clase importante que pueden usarse como intermedios para la síntesis de productos farmacéuticos y bloques de construcción para la construcción de inhibidores. La bis-alcoxicarbonilación de alquenos catalizada por paladio proporciona métodos efectivos para la construcción de estos compuestos. En 1970, Heck reportó el primer ejemplo de la reacción y su versión asimétrica apareció después de casi 20 años. La Figura\(\PageIndex{4}\) resume algunos de los ligandos empleados para las reacciones de bis-alcoxicarbonilación. Se han tamizado fosfina bidentada quiral, P-N y S, N-ligandos y se reportó alta enantioselectividad (92%) en la bis-metoxicarbonilación de estireno con quimioselectividad moderada (50%) empleando 21 como ligando. En el caso del propeno, 60% ee se observa como la enantioselectividad más alta con mala quimioselectividad y conversión (13% y 23%, respectivamente), mientras que la reacción del 4-metil-1-penteno dio buena quimioselectividad (79%) pero con menor enantioselectividad (14% ee).
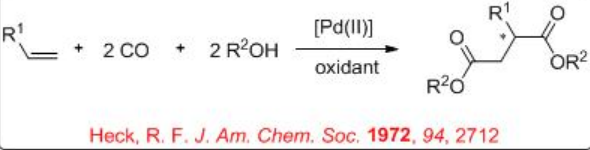
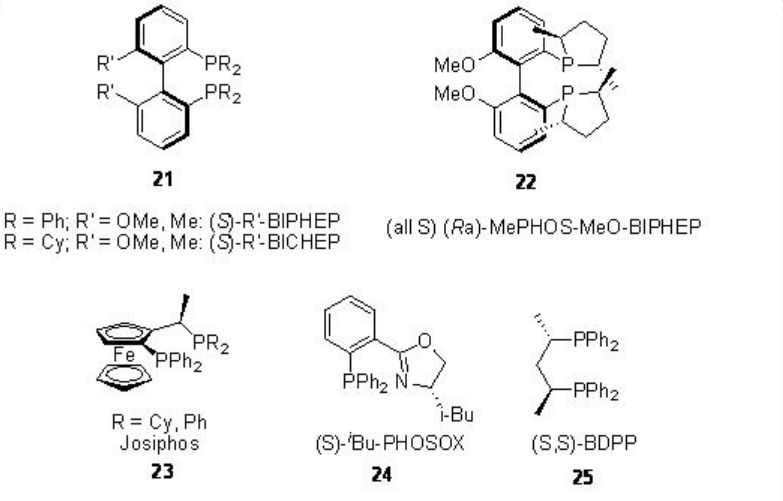
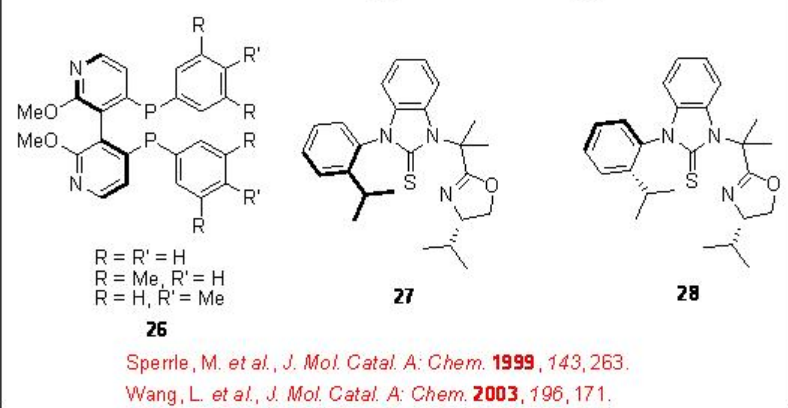
Figura\(\PageIndex{4}\): Ligandos utilizados en bis-alcoxicarbonilación asimétrica de alquenos


