11.3: Reacciones de reducción
- Page ID
- 73284
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)La reducción enantioselectiva de dobles enlaces C=X (X = O, NR, C) a enlaces simples C-XH juega un papel importante en la síntesis asimétrica.
Reducción de Cetonas
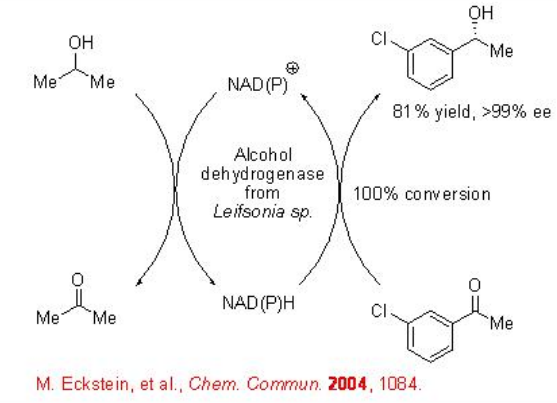
La reducción enantioselectiva de cetonas representa un enfoque atómico económico hacia alcoholes ópticamente activos. La reducción biocatalítica de cetonas se basa en el uso de una alcohol deshidrogenasa (ADH) como catalizador, y un cofactor como agente reductor. Por ejemplo, ADH de Leifsonia sp. cataliza la reducción de acetofenona sustituida para dar alcoholes secundarios con alta enantioselectividad (Esquema\(\PageIndex{1}\)). En este proceso, el 2-propanol actúa como un agente reductor que se oxida en acetona.
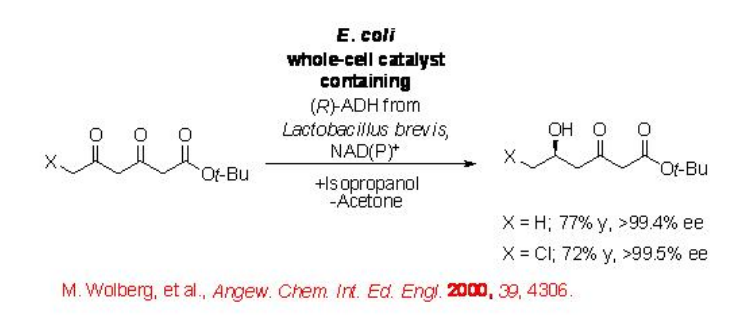
El grupo ceto de 2,5-diceto éster se puede reducir selectivamente con excelente regio- y enantioselectividad usando células de E. coli con ADH sobreexpresada de Lactobacillus brevis (Esquema\(\PageIndex{2}\)). En este proceso el 2-propanol actúa como agente reductor oxidante en acetona.
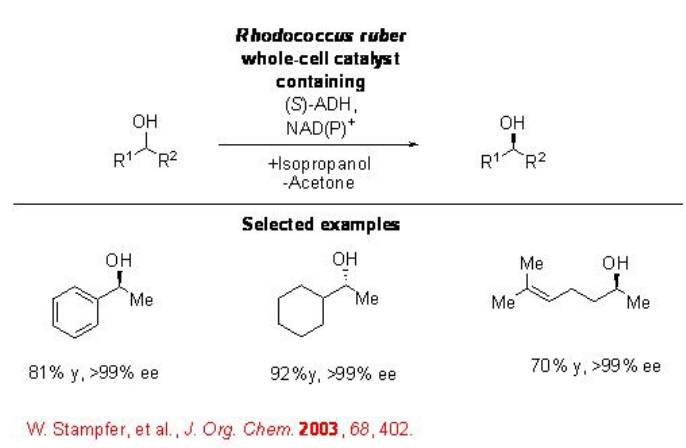
La reducción de una amplia gama de cetonas alifáticas y aromáticas se puede lograr empleando R. ruber ADH para dar los alcoholes correspondientes con excelente enantioselectividad en 2-propanol (Esquema\(\PageIndex{7}\)).
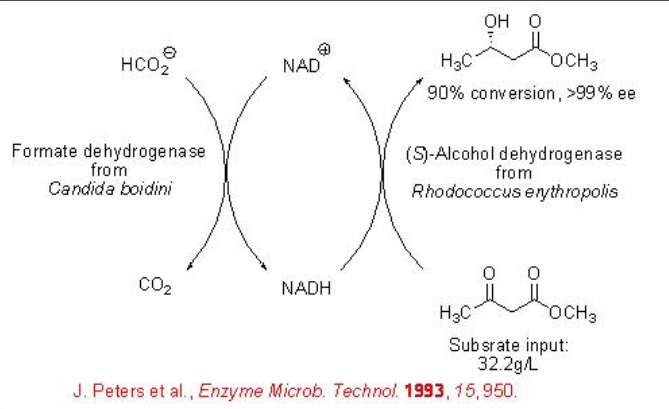
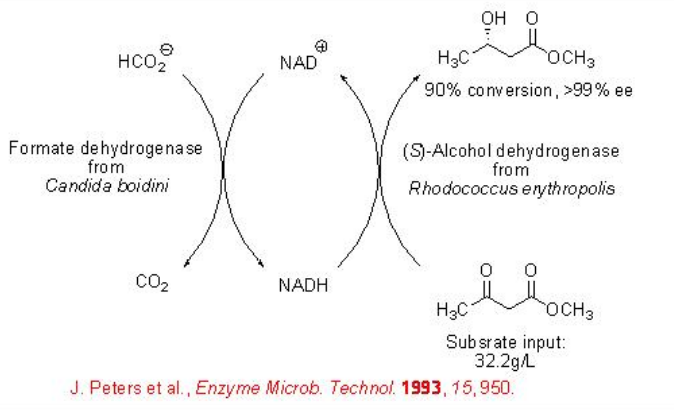
Mientras que la formiato deshidrogenasa (FDH) de C. boidinii cataliza selectivamente la reducción del grupo ceto de β-ceto ésteres con alta enantioselectividad. En esta reacción, el formiato se oxida en dióxido de carbono (Esquema\(\PageIndex{4}\)).
La célula entera basada en FDH se puede utilizar para la reducción de 4-cloro-3-oxobutanoato de etilo con 99% ee (Esquema\(\PageIndex{5}\)).
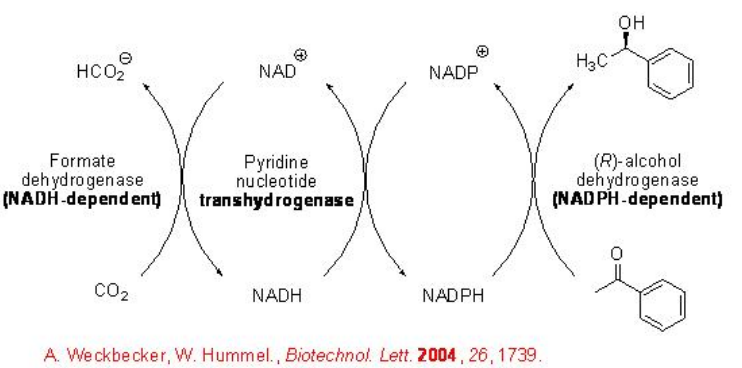
El uso de FDH de C. boidinii tiene limitación debido a su incapacidad para regenerar NADP +. Esto se ha superado al ampliar el rango de aplicación de la regeneración de cofactores basada en FDH a ADH dependientes de NADP + (Esquema\(\PageIndex{6}\)). Esto implica la integración de una etapa enzimática adicional dentro del ciclo de cofactor-regeneración que se ejemplifica en la reducción de acetofenona a (R) -feniletanol. En este proceso, la piridina nucleótido transhidrogenasa (PNT) -cataliza la regeneración de NADPH a partir de NADP + bajo consumo de NADH formando NAD +.
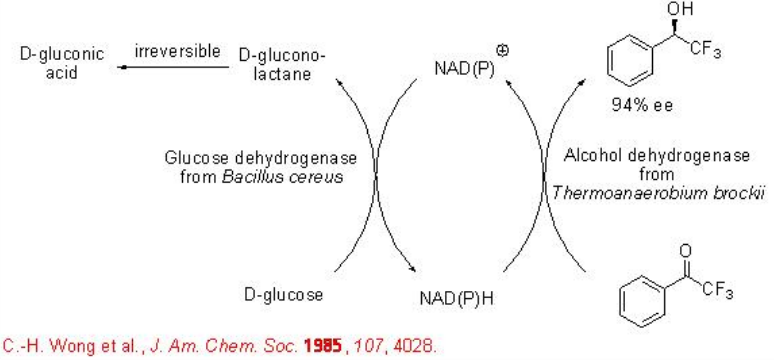
Además, para reciclar el cofactor NAD (P) H, se ha demostrado el uso de una glucosa deshidrogenasa (GDH). En este sistema, la D-glucosa se oxida a D-gluconolactona, mientras que el cofactor oxidado NAD (P +) se reduce a NAD (P) H. Dado que la D-gluconolactona se hidroliza en ácido D-glucónico, la reacción es irreversible desplazando todo el proceso hacia la formación deseada del producto alcohólico. Este proceso de regeneración de cofactores acoplados a GDH se ha utilizado para la reducción de cetona a alcohol con alta enantioselectividad (Esquema\(\PageIndex{7}\)).
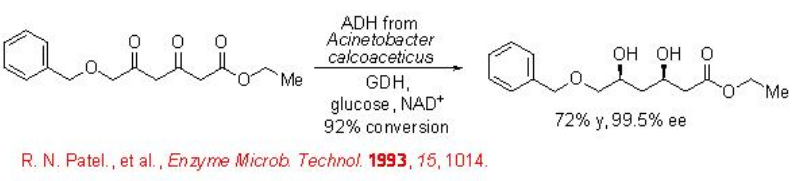
Este principio se ha utilizado recientemente para la reducción de 6-benciloxi-3,5-dioxohexanoato de etilo para proporcionar (3R,5S) -6-benciloxi-3,5-dihidroxihexanoato de etilo con 99% ee empleando ADH de Acinetobacter calcoaceticus en combinación con un GDH y glucosa (Esquema \(\PageIndex{8}\)).
Reducción de Cetonas
Se ha desarrollado un sistema catalítico recombinante de células enteras con E. coli, que coexpresa tanto la ADH de S. salmonicolor como la GDH de B. megaterium, para la reducción asimétrica de 4-cloro-3-oxobutanoato en una mezcla de acetato de n-butil /agua ( Esquema\(\PageIndex{9}\)). Es un enfoque elegante hacia los biocatalizadores hechos a medida que contienen las dos enzimas deseadas, ADH y GDH, en forma sobreexpresada (Esquema\(\PageIndex{9}\)).
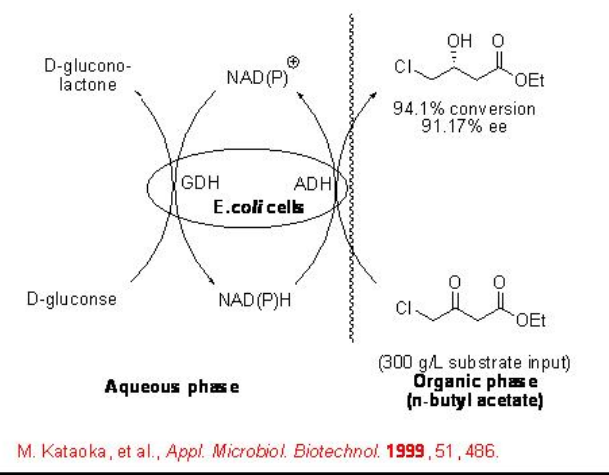
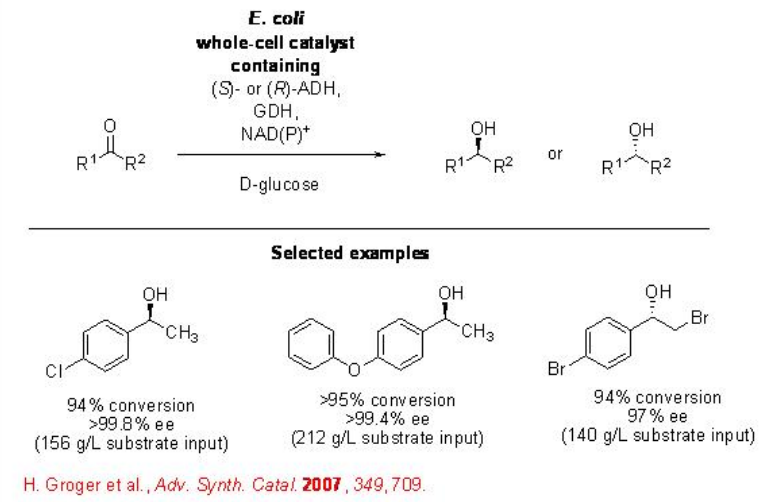
La aplicación del sistema biocatalítico recombinante de células enteras se ha demostrado adicionalmente en medios acuosos puros sin necesidad de adición de cantidad externa de cofactor (Esquema\(\PageIndex{10}\)). Este método es económico y sencillo, y encuentra aplicaciones para la reducción de una amplia gama de cetonas (Esquema\(\PageIndex{10}\)).
Aminación reductora de α-Keto Ácidos
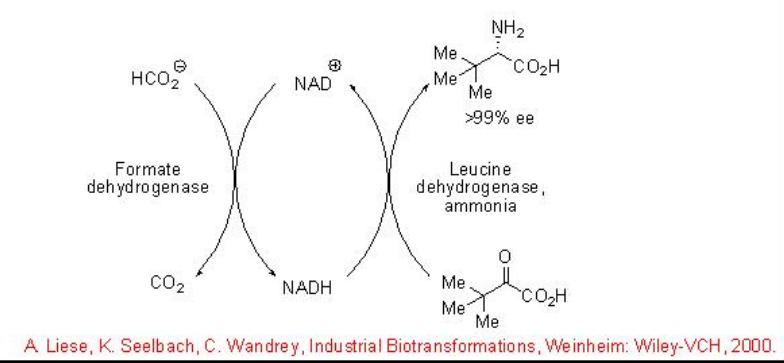
La aminación reductora asimétrica catalizada por enzimas de α-ceto ácidos representa un método sencillo para acceder a α -aminoácidos ópticamente activos. Por ejemplo, la L-terc- leucina, que sirve como bloque de construcción para la industria farmacéutica, se obtiene con alta conversión y enantioselectividad utilizando una leucina deshidrogenasa para la aminación reductora y una FDH de C.boidinii (Esquema\(\PageIndex{11}\)). Este último es requerido para un reciclaje in situ del cofactor NADH.
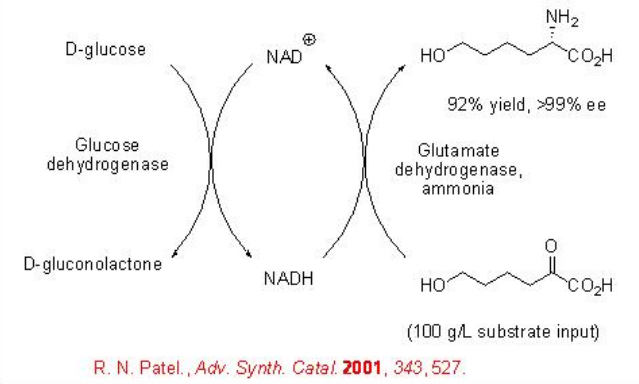
De igual manera, la síntesis de L-6-hidroxinorleucina se puede lograr a partir de α-ceto ácido con conversión completa y enantioselectividad > 99% (Esquema\(\PageIndex{12}\)). En esta reacción, se ha utilizado una glutamato deshidrogenasa de hígado de res como L-aminoácido deshidrogenasa y se ha utilizado una GDH de B. megaterium para la regeneración del cofactor.
Sin embargo, la necesidad de la adición del costoso cofactor NAD + así como el aislamiento y costo de las enzimas hacen que estos enfoques sean limitados. Así, se han realizado esfuerzos para abordar estos aspectos mediante el empleo de un catalizador de célula completa, que tiene tanto un aminoácido deshidrogenasa como FDH en forma sobreexpresada. Por ejemplo, la síntesis de etileno acetal de L-alysina se ha mostrado usando un catalizador de células enteras, células de Pichia pastoris que tienen una fenilalanina deshidrogenasa de Thermoactinomyces intermedius y una FDH de P. pastoris (Esquema\(\PageIndex{13}\)).
Reducción de los dobles enlaces carbono-carbono activado
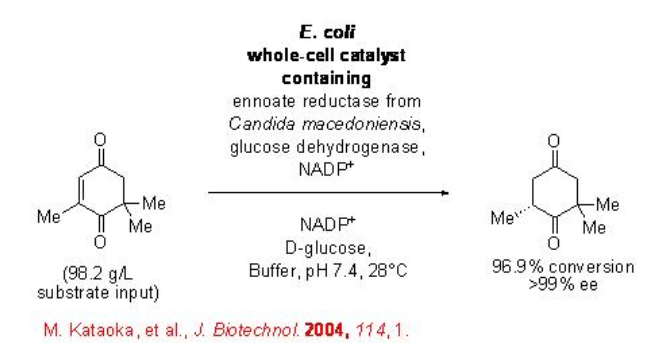
La reducción de los dobles enlaces carbono-carbono utilizando los sistemas biocatalíticos tiene un alto potencial en química orgánica. Sin embargo, este proceso es menos explorado en comparación con la reducción C=O de cetonas y ceto ésteres. La reducción del doble enlace carbono-carbono en la cetoisoforona se ha logrado utilizando un catalizador de células enteras que sobreexpresa una enolato reductasa de Candida macedoniensis y una GDH (Esquema\(\PageIndex{13}\)). Este estudio puede considerarse como uno de los trabajos pioneros en la reducción de dobles enlaces carbono-carbono mediante sistemas biocatalíticos.
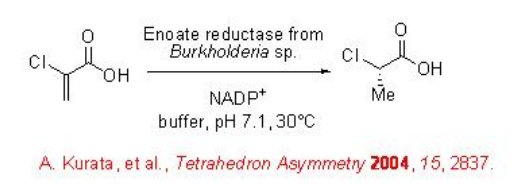
Los ácidos carboxílicos α, β -insaturados también se pueden utilizar como sustratos. Por ejemplo, el ácido α -cloroacrílico se puede convertir en α -cloropropionato usando una enolato reductasa de Burkholderia sp., en alta enantioselectividad (Esquema\(\PageIndex{14}\)).
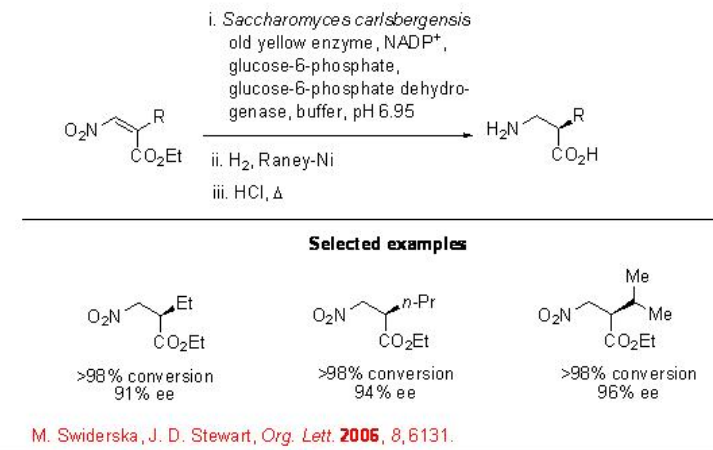
Además, la enona y el ácido carboxílico α, β -insaturado, los nitroalcanos también son sustratos adecuados para la enoato reductasa. Por ejemplo, la reducción del doble enlace carbono-carbono en Z-nitroalquenos procede a la reacción para dar 3-nitropropanoatos 2-sustituidos con alta conversión y en la mayoría de los casos con alta enantioselectividad (Esquema\(\PageIndex{15}\)).
Transaminación\(\PageIndex{1}\)
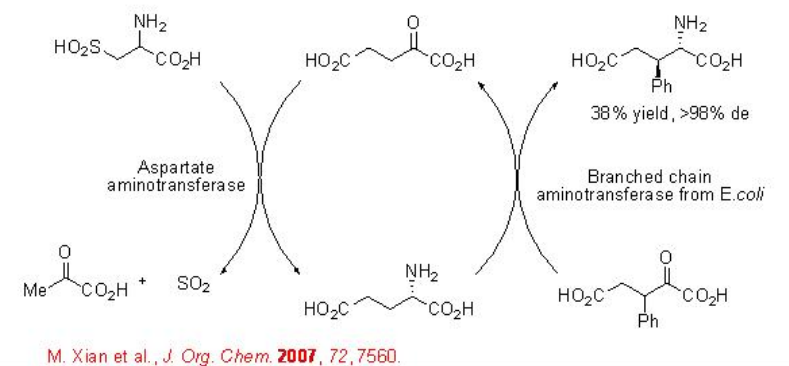
Dependiendo de la naturaleza de la transaminasa, los α-ceto ácidos y cetonas proceden a la reacción para dar α-aminoácidos y aminas con un centro estereogénico en posición α, respectivamente. Por ejemplo, un acoplamiento del proceso de transaminasa con un proceso de transaminación irreversible catalizado por aspartato aminotransferasa usando ácido cisteína sulfínico como donante de amino se ha utilizado para la síntesis de varios tipos de análogos de ácido glutámico no naturales 3 o 4 sustituidos (Esquema\(\PageIndex{16}\)).
Además, la síntesis altamente eficiente de (S) -metoxiisopropilamina se ha logrado usando un catalizador recombinante de células enteras que sobreexpresa una transaminasa. Una característica clave en este proceso es la alta concentración de sustrato y la molécula diana deseada se puede obtener con excelente enantioselectividad (Esquema\(\PageIndex{17}\)).



