4.1: Grupos Funcionales Hidrocarburos
- Page ID
- 76376
Objetivo de aprendizaje
- distinguir entre los diferentes grupos funcionales hidrocarbonados
Moléculas saturadas vs.
Los hidrocarburos son compuestos orgánicos que contienen solo carbono e hidrógeno. La distinción más amplia entre hidrocarburos es si están saturados e insaturados. Los hidrocarburos saturados solo contienen enlaces simples carbono-carbono con el número máximo de hidrógenos en relación con el número de átomos de carbono. Se puede decir que los átomos de carbono están “saturados” con átomos de hidrógeno de la misma manera que una solución saturada ha disuelto la cantidad máxima de soluto. Los hidrocarburos que contienen enlaces pi como dobles o triples enlaces carbono-carbono se clasifican como hidrocarburos insaturados. La insaturación indica que algunos de los enlaces carbono-hidrógeno se perdieron de los enlaces pi entre los átomos de carbono. Hay menos que el número máximo de hidrógenos en relación con el número de átomos de carbono.
- Los hidrocarburos saturados (alcanos) son los más simples de las especies de hidrocarburos. Están compuestos enteramente por enlaces simples y están saturados con hidrógeno. Los hidrocarburos saturados son la base de los combustibles del petróleo y se encuentran como especies lineales o ramificadas.Los alcanos más simples tienen sus átomos de C unidos en una cadena lineal; estos se denominan alcanos normales. Se nombran según el número de átomos de C en la cadena. El alcano más pequeño es el metano:
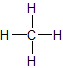
2. Los hidrocarburos insaturados tienen uno o más dobles o triples enlaces entre los átomos de carbono. Aquellos con doble enlace se llaman alquenos y aquellos con un doble enlace tienen la fórmula\(C_nH_{2n}\) (asumiendo estructuras no cíclicas). Los que contienen enlaces triples se denominan alquinos, con fórmula general C n H 2n-2.
El alqueno más pequeño, el eteno, tiene dos átomos de C y también es conocido por su nombre común etileno:
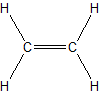
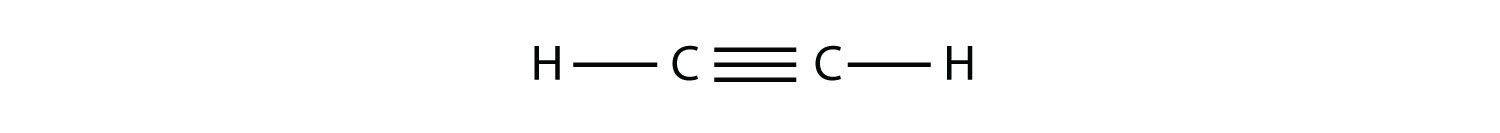
3. Por ahora, nos centraremos en el benceno como el hidrocarburo aromático representativo. Los compuestos aromáticos se destacaron primero por sus fuertes aromas y baja reactividad química en comparación con otros hidrocarburos saturados. Los compuestos aromáticos serán discutidos con mayor detalle en el segundo semestre a la química orgánica.
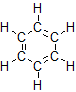
Grupos Funcionales Hidrocarburos
Los cuatro grupos funcionales hidrocarbonados distintos son: alcanos, alquenos, alquinos y arenos. Los compuestos aromáticos derivan sus nombres del hecho de que muchos de estos compuestos en los primeros días del descubrimiento se agruparon porque eran aceites con olores fragantes.
Los alcanos son compuestos orgánicos que consisten completamente en átomos de carbono e hidrógeno de enlace simple y carecen de otros grupos funcionales. Los alcanos tienen la fórmula general C n H 2n +2. Los alcanos se pueden subdividir en los siguientes tres grupos: los alcanos lineales de cadena lineal, alcanos ramificados y cicloalcanos. Los alcanos también son hidrocarburos saturados. Los alcanos son las especies de hidrocarburos más simples y menos reactivas que contienen solo carbonos e hidrógenos. La característica distintiva de un alcano, diferenciándolo de otros compuestos que también contienen exclusivamente carbono e hidrógeno, es su falta de insaturación. Es decir, no contiene dobles o triples enlaces, los cuales son altamente reactivos en química orgánica. Aunque no están totalmente desprovistos de reactividad, su falta de reactividad en la mayoría de las condiciones de laboratorio los convierte en un componente relativamente poco interesante, aunque muy importante de la química orgánica. Como conocerás más adelante, la energía confinada dentro del enlace carbono-carbono y el enlace carbono-hidrógeno es bastante alta y su rápida oxidación produce una gran cantidad de calor, típicamente en forma de fuego.
La fórmula general para hidrocarburos saturados es C n H 2n +2 (asumiendo estructuras no cíclicas) como se muestra en hexano (C 6 H 14) a continuación.
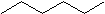
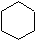
Los cicloalcanos son hidrocarburos que contienen uno o más anillos de carbono a los que están unidos los átomos de hidrógeno. La fórmula general para un hidrocarburo cíclico que contiene un anillo es C n H 2n como se muestra en ciclohexano (C 6 H 12) a continuación.
Los acenos contienen al menos un doble enlace carbono-carbono y los alquinos contienen al menos un triple enlace carbono-carbono. Los alquenos tienen la fórmula general C n H 2n. Los alquinos tienen la fórmula general C n H 2n -2. La relación de carbono a hidrógeno aumentó debido a que los átomos de hidrógeno son reemplazados por enlaces pi como se muestra en trans-2-buteno (C 4 H 8) y 2-butino (C 4 H 6) a continuación. Dado que tanto los enlaces dobles como los triples incluyen enlaces pi, los alquenos y alquinos comparten una reactividad química similar.

Los hidrocarburos aromáticos, también conocidos como arenos, son hidrocarburos que tienen al menos un anillo aromático. Los compuestos aromáticos contienen la unidad de benceno. El benceno mismo está compuesto por seis átomos de C en un anillo, con enlaces C—C simples y dobles alternantes:

Cálculo de Grados de Insaturación (DU)
Hay muchas maneras de determinar la estructura de una molécula orgánica desconocida. Si bien la resonancia magnética nuclear (RMN) y la radiación infrarroja (IR) son las principales formas de determinar las estructuras moleculares, calcular los grados de insaturación (DU) es información útil. Conocer los grados de insaturación nos dice el número combinado de enlaces pi y anillos dentro de un compuesto lo que facilita la comprensión de la estructura molecular.
El grado de insaturación (DU) se puede calcular con la siguiente ecuación y la fórmula molecular
DU= (2C+2+N-X-H) /2
donde: C es el número de carbonos; N es el número de nitrógenos; X es el número de halógenos (F, Cl, Br, I); y H es el número de hidrógenos de la fórmula molecular.
Como se indicó anteriormente, una molécula saturada contiene solo enlaces simples y no tiene anillos. Otra forma de interpretar esto es que una molécula saturada tiene el número máximo de átomos de hidrógeno posible para ser un alcano acíclico. Así, el número de hidrógenos puede ser representado por 2C+2, que es la representación molecular general de un alcano. Como ejemplo, para la fórmula molecular C 3 H 4 el número de hidrógenos reales necesarios para que el compuesto se sature es 8 [2C+2 =( 2x3) +2=8]. El compuesto necesita 4 hidrógenos más para estar completamente saturado (número esperado de hidrógenos-número observado de hidrógenos=8-4=4). Los grados de insaturación son iguales a 2, o la mitad del número de hidrógenos que la molécula necesita ser clasificada como saturada. De ahí que la fórmula DoB se divida por 2. La fórmula resta el número de X porque un halógeno (X) reemplaza a un hidrógeno en un compuesto. Por ejemplo, en cloroetano, C 2 H 5 Cl, hay uno menos de hidrógeno en comparación con el etano, C 2 H 6.
Para que un compuesto esté saturado, hay un hidrógeno más en una molécula cuando el nitrógeno está presente. Por lo tanto, sumamos el número de nitrógenos (N). Esto se puede observar con C 3 H 9 N en comparación con C 3 H 8. El oxígeno y el azufre no están incluidos en la fórmula porque la saturación no se ve afectada por estos elementos. Como se observa en los alcoholes, el mismo número de hidrógenos en etanol, C 2 H 5 OH, coincide con el número de hidrógenos en etano, C 2 H 6.
La siguiente tabla ilustra las posibles combinaciones del número de enlaces dobles, enlaces triples y/o anillos para un grado dado de insaturación. Cada fila corresponde a una combinación diferente.
- Un grado de insaturación equivale a 1 anillo o 1 doble enlace (1\( \pi \) enlace).
- Dos grados de insaturación equivalen a 2 dobles enlaces, 1 anillo y 1 doble enlace, 2 anillos o 1 triple enlace (2\( \pi \) enlaces).
|
DU
|
Posibles combinaciones de anillos/enlaces
|
||
|---|---|---|---|
|
|
# de anillos
|
# de dobles enlaces
|
# de bonos triples
|
|
1
|
1
|
0
|
0
|
|
|
0
|
1
|
0
|
|
2
|
2
|
0
|
0
|
|
|
0
|
2
|
0
|
|
|
0
|
0
|
1
|
|
|
1
|
1
|
0
|
| 3 | 3 | 0 | 0 |
| 2 | 1 | 0 | |
| 1 | 2 | 0 | |
| 0 | 1 | 1 | |
| 0 | 3 | 0 | |
| 1 | 0 | 1 | |
Recuerda, los grados de insaturación sólo dan la suma de dobles enlaces, triples enlaces y/o anillos. Por ejemplo, un grado de insaturación de 3 puede contener 3 anillos, 2 anillo+1 doble enlace, 1 anillo+2 dobles enlaces, 1 anillo+1 triple enlace, 1 enlace doble+1 triple enlace, o 3 dobles enlaces.
Ejemplo
¿Cuál es el Grado de Insaturación para el benceno?
Solución - “Pensándolo bien”
La fórmula molecular para el benceno es C 6 H 6. Por lo tanto,
DU= 4, donde C=6, N=0, X=0 y H=6. 1 DU puede ser igual a 1 anillo o 1 doble enlace. Esto corresponde a benceno que contiene 1 anillo y 3 dobles enlaces.
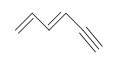
A pesar de que existen otras estructuras posibles con una DU = 4, como las que se muestran a continuación. Aprenderemos que los anillos de benceno tienen una estabilidad inusual y ocurren frecuentemente en el mundo de la química orgánica. Cuando el DU para un compuesto es > 4, podemos suponer la presencia de al menos un anillo de benceno.
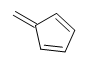
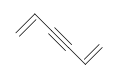
Ejercicio
- Son las siguientes moléculas saturadas o insaturadas:
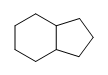 b.)
b.) 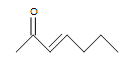 (c.)
(c.) 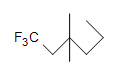 d.) C 10 H 6 N 4
d.) C 10 H 6 N 4
- Usando las moléculas de 1., dar los grados de insaturación para cada una.
- Calcular los grados de insaturación para las siguientes fórmulas moleculares:
- (a.) C 9 H 20 b.) C 7 H 8 (c.) C 5 H 7 Cl (d.) C 9 H 9 NO 4
- Usando las fórmulas moleculares de 3, son las moléculas insaturadas o saturadas.
- Usando las fórmulas moleculares de 3, si las moléculas son insaturadas, ¿cuántos anillos/dobles enlaces/triples enlaces se pronostican?
- Responder
-
1.
(a.) sin saturar (E aunque los anillos solo contienen enlaces simples, los anillos se consideran insaturados).
b.) insaturado
(c.) saturado
d.) insaturado
2. Si se da la estructura molecular, la forma más fácil de resolver es contar el número de dobles enlaces, triples enlaces y/o anillos. Sin embargo, también se puede determinar la fórmula molecular y resolver los grados de insaturación mediante el uso de la fórmula.
(a.) 2
b.) 2 (un doble enlace y el doble enlace del carbonilo)
(c.) 0
d.) 10
3. Usa la fórmula para resolver
(a.) 0
b.) 4
(c.) 2
d.) 6
4.
(a.) saturado
b.) insaturado
(c.) insaturado
d.) insaturado
5.
(a.) 0 (Recordar: una molécula saturada solo contiene enlaces simples)
b.) La molécula puede contener cualquiera de estas combinaciones (i) 4 dobles enlaces (ii) 4 anillos (iii) 2 enlaces dobles+2 anillos (iv) 1 enlace doble+3 anillos (v) 3 enlaces dobles+1 anillo (vi) 1 triple enlace+2 anillos (vii) 2 enlaces triples (viii) 1 enlace triple+1 enlace doble+1 anillo (ix) 1 triple enlace+2 dobles enlaces
(c.) (i) 1 triple enlace (ii) 1 anillo+1 doble enlace (iii) 2 anillos (iv) 2 dobles enlaces
d.) (i) 3 enlaces triples (ii) 2 enlaces triples +2 dobles enlaces (iii) 2 enlaces triples +1 doble enlace+1 anillo (iv)... (Como puede ver, los grados de insaturación sólo dan la suma de dobles enlaces, triples enlaces y/o anillo. Así, la fórmula puede dar numerosas estructuras posibles para una fórmula molecular dada).
Referencias
- Vollhardt, K. P.C. & Shore, N. (2007). Química Orgánica (5ª Ed.). Nueva York: W. H. Freeman. (473-474)
- Shore, N. (2007). Guía de Estudio y Manual de Soluciones para Química Orgánica (5ª Ed.). Nueva York: W.H. Freeman. (201)
Colaboradores y Atribuciones
- Kim

