6.11: Quiralidad en nitrógeno, fósforo y azufre
- Page ID
- 76403
Objetivo de aprendizaje
- interpretar el estereoisomería de compuestos con nitrógeno, fósforo o azufre como centros quirales
Nitrógeno estereogénico
El nitrógeno de enlace simple tiene forma piramidal, con el par de electrones sin enlace apuntando a la esquina desocupada de una región tetraédrica. Dado que el nitrógeno en estos compuestos está unido a tres grupos diferentes, su configuración es quiral. Las configuraciones de imagen especular no idénticas se ilustran en el siguiente diagrama (el resto de la molécula está representado por R, y el par de electrones es de color amarillo). Si estas configuraciones fueran estables, habría cuatro estereoisómeros adicionales de efedrina y pseudoefedrina. Sin embargo, el nitrógeno piramidal normalmente no es configuracionalmente estable. Rápidamente invierte su configuración (flechas de equilibrio) al pasar por un estado de transición plano hibridado sp 2, lo que lleva a una mezcla de configuraciones R y S interconvertidoras. Si el átomo de nitrógeno fuera el único centro quiral en la molécula, existiría en equilibrio una mezcla 50:50 (racémica) de configuraciones R y S. Si están presentes otros centros quirales, como en los isómeros de la efedrina, resultará una mezcla de diastereómeros. El mensaje para llevar a casa es que el nitrógeno no contribuye a los estereoisómeros aislables.
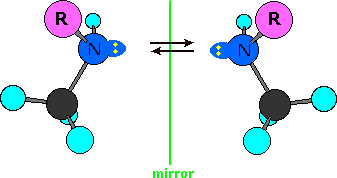
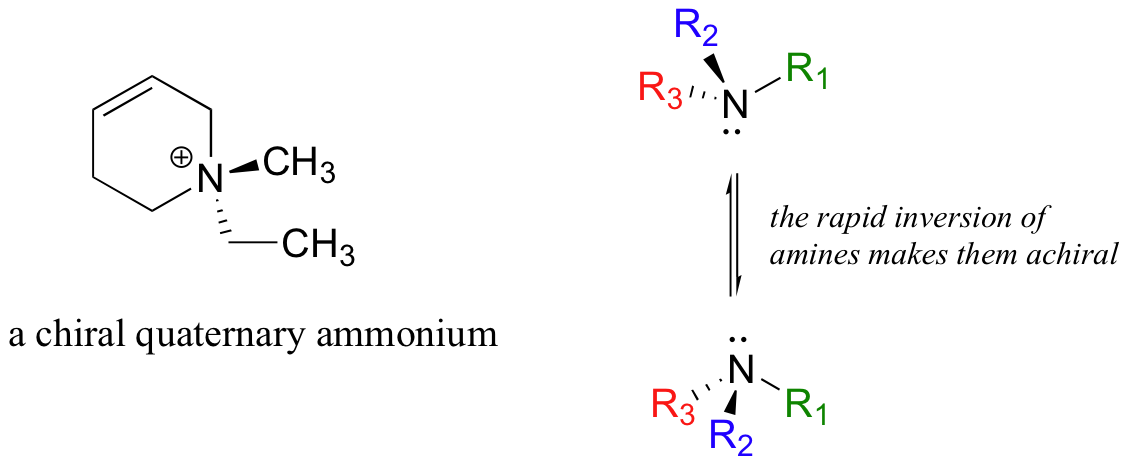
Los grupos amonio cuaternario asimétricos también son quirales. Las aminas, sin embargo, no son quirales, porque se invierten rápidamente, o se vuelven “de adentro hacia afuera”, a temperatura ambiente.
El centro de fósforo del ion fosfato y los ésteres de fosfato orgánicos, por ejemplo, es tetraédrico, y por lo tanto es potencialmente un estereocentro.
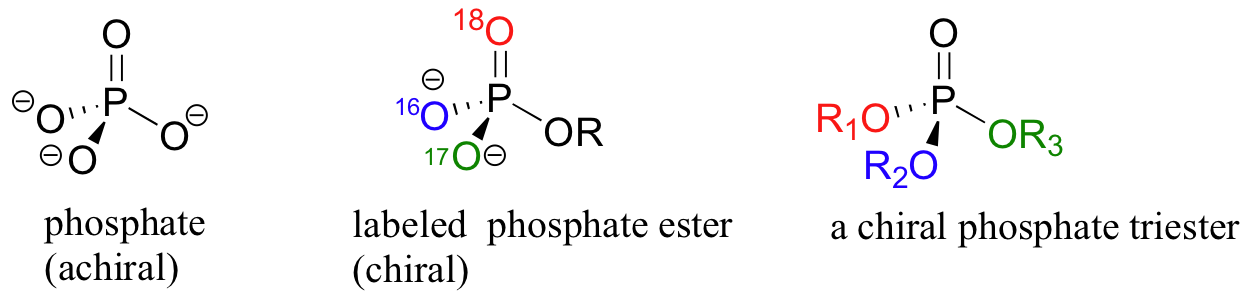
Veremos en el capítulo 10 cómo los investigadores, con el fin de investigar la estereoquímica de las reacciones en el centro del fosfato, incorporaron azufre y/o 17 O y 18 O isótopos de oxígeno (el isótopo 'normal' es 16 O) para crear grupos fosfato quirales. Los triésteres de fosfato son quirales si los tres grupos sustituyentes son diferentes.
Colaboradores y Atribuciones
Dr. Dietmar Kennepohl FCIC (Professor of Chemistry, Athabasca University)
William Reusch, Professor Emeritus (Michigan State U.), Virtual Textbook of Organic Chemistry
Prof. Steven Farmer (Sonoma State University)
Organic Chemistry With a Biological Emphasis by Tim Soderberg (University of Minnesota, Morris)

