8.4: Grados de insaturación
- Page ID
- 76952
Objetivos de aprendizaje
- calcular los Grados de Insaturación (DU) y aplicarlo a la estructura alqueno
Moléculas Saturadas e No
En el laboratorio, la saturación puede considerarse como el punto en el que una solución ya no puede disolver una sustancia añadida a ella. En cuanto a grados de insaturación, se considera saturada una molécula que solo contiene enlaces sencillos sin anillos.
| CH 3 CH 2 CH 3 | 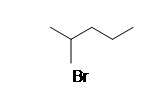 |
.bmp) |
1-metioxipentano |
A diferencia de las moléculas saturadas, las moléculas insaturadas contienen doble enlace (s), triple enlace (s) y/o anillo (s).
| CH 3 CH=CHCH 3 |  |
 |
 |
3-cloro-5-octina |
Hay muchas maneras de determinar la estructura de una molécula orgánica desconocida. Aunque la resonancia magnética nuclear (RMN) y la radiación infrarroja (IR) son las principales formas de determinar las estructuras moleculares, estas técnicas requieren instrumentación costosa y no siempre están fácilmente disponibles. Afortunadamente, calcular los grados de insaturación proporciona información útil sobre la estructura. El grado de insaturación indica el número total de enlaces pi y anillos dentro de una molécula, lo que facilita la comprensión de la estructura molecular.
DU = Grados de insaturación = (número de enlaces pi) + (número de anillos)
Los alquenos (R2 C=CR 2) y los alquinos (R—C=C-R) se denominan hidrocarburos insaturados porque tienen menos átomos de hidrógeno que un alcano con el mismo número de átomos de carbono, como se indica en las siguientes fórmulas generales:
Cálculo del grado de insaturación (DU)
Si se da la fórmula molecular, conecte los números en esta fórmula:
\[ DoU= \dfrac{2C+2+N-X-H}{2} \tag{7.2.1}\]
- \(C\)es el número de carbonos
- \(N\)es el número de nitrógenos
- \(X\)es el número de halógenos (F, Cl, Br, I)
- \(H\)es el número de hidrógenos
La fórmula molecular de un hidrocarburo proporciona información sobre los posibles tipos estructurales que puede representar. Una molécula saturada contiene solo enlaces simples y no tiene anillos. Otra forma de interpretar esto es que una molécula saturada tiene el número máximo de átomos de hidrógeno posible para ser un alcano acíclico. Así, el número de hidrógenos puede ser representado por 2C+2, que es la representación molecular general de un alcano. Como ejemplo, para la fórmula molecular C3H4 el número de hidrógenos reales necesarios para que el compuesto se sature es 8.
[2C+2= (2x3) +2=8.]
El compuesto necesita 4 hidrógenos más para estar completamente saturado (número esperado de hidrógenos-número observado de hidrógenos=8-4=4). Los grados de insaturación son iguales a 2, o la mitad del número de hidrógenos que la molécula necesita ser clasificada como saturada. De ahí que la fórmula DoB se divida por 2. La fórmula resta el número de X porque un halógeno (X) reemplaza a un hidrógeno en un compuesto. Por ejemplo, en cloroetano, C2H5Cl, hay uno menos de hidrógeno en comparación con el etano, C2H6. Por ejemplo, considere los compuestos que tienen la fórmula C5H8. La fórmula del alcano pentano de cinco carbonos es C5H12 por lo que la diferencia en el contenido de hidrógeno es 4. Esta diferencia sugiere que tales compuestos pueden tener un triple enlace, dos dobles enlaces, un anillo más un doble enlace, o dos anillos. Aquí se muestran algunos ejemplos, ¡y hay por lo menos otros catorce!
Para que un compuesto esté saturado, hay un hidrógeno más en una molécula cuando hay nitrógeno presente. Por lo tanto, sumamos el número de nitrógenos (N). Esto se puede observar con C 3 H 9 N en comparación con C 3 H 8. El oxígeno y el azufre no están incluidos en la fórmula porque la saturación no se ve afectada por estos elementos. Como se observa en los alcoholes, el mismo número de hidrógenos en etanol, C 2 H 5 OH, coincide con el número de hidrógenos en etano, C 2 H 6.
La siguiente tabla ilustra las posibles combinaciones del número de enlaces dobles, enlaces triples y/o anillos para un grado dado de insaturación. Cada fila corresponde a una combinación diferente.
- Un grado de insaturación equivale a 1 anillo o 1 doble enlace (1\( \pi \) enlace).
- Dos grados de insaturación equivalen a 2 dobles enlaces, 1 anillo y 1 doble enlace, 2 anillos o 1 triple enlace (2\( \pi \) enlaces).
Cuando el DU es 4 o mayor, es muy probable la presencia de anillos de benceno.
|
DU
|
Posibles combinaciones de anillos/enlaces
|
||
|---|---|---|---|
|
|
# de anillos
|
# de dobles enlaces
|
# de bonos triples
|
|
1
|
1
|
0
|
0
|
|
|
0
|
1
|
0
|
|
2
|
2
|
0
|
0
|
|
|
0
|
2
|
0
|
|
|
0
|
0
|
1
|
|
|
1
|
1
|
0
|
Recuerda, los grados de insaturación sólo dan la suma de dobles enlaces, triples enlaces y/o anillos. Por ejemplo, un grado de insaturación de 3 puede contener 3 anillos, 2 anillo+1 doble enlace, 1 anillo+2 dobles enlaces, 1 anillo+1 triple enlace, 1 doble enlace +1 triple enlace, o 3 dobles enlaces.
Ejemplo: Benceno
¿Cuál es el Grado de Insaturación para el Benceno?
Solución
La fórmula molecular para el benceno es C 6 H 6. Por lo tanto,
DU= 4, donde C=6, N=0, X=0 y H=6. 1 DoB puede ser igual a 1 anillo o 1 doble enlace. Esto corresponde a benceno que contiene 1 anillo y 3 dobles enlaces.

Sin embargo, cuando se le da la fórmula molecular C 6 H 6, el benceno es solo una de las muchas estructuras posibles (isómeros). Las siguientes estructuras tienen todas DU de 4 y tienen la misma fórmula molecular que el benceno. Sin embargo, estos compuestos son muy raros, a diferencia del benceno. Aprenderemos más sobre las razones de la alta estabilidad de benzen cuando estudiemos la aromaticidad en capítulos posteriores.
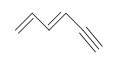
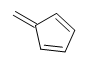
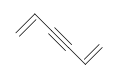
Ejercicios
- Son las siguientes moléculas saturadas o insaturadas:
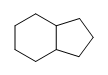 b.)
b.) 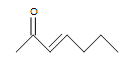 (c.)
(c.) 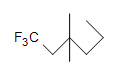 (d.) C 10 H 6 N 4
(d.) C 10 H 6 N 4
- Usando las moléculas de (1) arriba, dar los grados de insaturación para cada una.
- Calcule los grados de insaturación, clasifique el compuesto como saturado o insaturado y enumere toda la combinación de enlaces anillo/pi posible para las siguientes fórmulas moleculares: (a.) C 9 H 20 b.) C 7 H 8 (c.) C 5 H 7 Cl (d.) C 9 H 9 NO 4
- Calcular grados de insaturación (DoU) para lo siguiente, y proponer una estructura para cada uno.
a) C 5 H 8
b) C 4 H 4
-
Calcular el grado de insaturación (DoU) para las siguientes moléculas
a) C 5 H 5 N
b) C 5 H 5 NO 2
c) C 5 H 5 Br
-
La siguiente molécula es la cafeína (C 8 H 10 N 4 O 2), determinar los grados de insaturación (DoU).
.png)
- Contestar
-
1.
(a.) sin saturar (E aunque los anillos solo contienen enlaces simples, los anillos se consideran insaturados).
b.) insaturado
(c.) saturado
d.) insaturado
2. Si se da la estructura molecular, la forma más fácil de resolver es contar el número de dobles enlaces, triples enlaces y/o anillos. Sin embargo, también se puede determinar la fórmula molecular y resolver los grados de insaturación usando la fórmula.
(a.) 2
b.) 2 (un doble enlace y el doble enlace del carbonilo)
(c.) 0
d.) 10
3.
(a.) DU = 0; saturado (Recordar una molécula saturada solo contiene enlaces simples)
b.) DU = 4; insaturado La molécula puede contener cualquiera de estas combinaciones de anillos y enlaces pi que suman 4, tales como (i) 4 dobles enlaces (ii) 4 anillos (iii) 2 enlaces dobles+2 anillos (iv) 1 enlace doble+3 anillos (v) 3 enlaces dobles+1 anillo (vi) 1 triple enlace +2 anillos ( vii) 2 enlaces triples (viii) 1 enlace triple+1 enlace doble+1 anillo (ix) 1 triple enlace +2 dobles enlaces
(c.) DU = 2; insaturado (i) 1 triple enlace (ii) 1 anillo+1 doble enlace (iii) 2 anillos (iv) 2 dobles enlaces
d.) DU = 6; (i) 3 enlaces triples (ii) 2 enlaces triples +2 dobles enlaces (iii) 2 enlaces triples +1 enlace doble+1 anillo (iv)... (Como puede ver, los grados de insaturación sólo dan la suma de dobles enlaces, triples enlaces y/o anillo. Así, la fórmula puede dar numerosas estructuras posibles para una fórmula molecular dada).
4.

5. a) 4 b) 4 c) 3
6. DU = 6

