9.10: Formación de Halohidrinas
- Page ID
- 75985
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Objetivo de aprendizaje
- predecir los productos/especificar los reactivos para la hidrohalogenación de alquenos
Introducción
El protón no es la única especie electrófila que inicia reacciones de adición al doble enlace de los alquenos. Los ácidos de Lewis como los halógenos, hidruros de boro y ciertos iones de metales de transición son capaces de aceptar los electrones pi de alqueno. Los intermedios cargados positivamente resultantes atraen nucleófilos para dar productos de adición.El carácter electrófilo de los halógenos es bien conocido. El flúor se agrega incontrolablemente con los alquenos, y la adición de yodo es desfavorable, por lo que estos no son métodos preparativos útiles. El cloro (Cl 2) y el bromo (Br 2) reaccionan selectivamente con el doble enlace de los alquenos, por lo que nos enfocaremos en estas reacciones.
La adición de cloro y bromo a los alquenos, como se muestra a continuación, produce dihalo-compuestos vecinales. En esta reacción, podemos suponer que el disolvente era algo que no es nucleofílico, como el tetrahidrofurano (THF).
R 2 C=CR 2 + X 2 —— > R 2 C X -CR 2 X
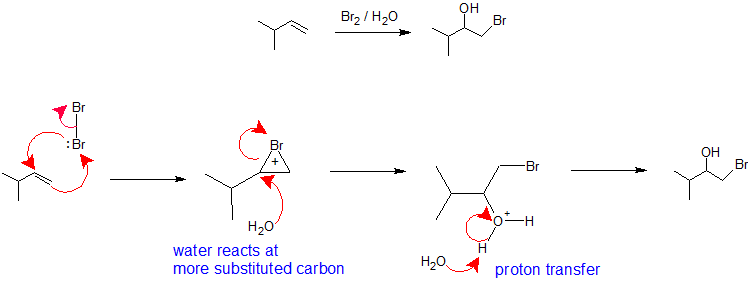
Si esta misma reacción se realiza en un disolvente nucleófilo como agua o un alcohol, entonces el disolvente se convierte en el nucleófilo en la segunda etapa y reacciona con el ion bromonio (o cloronio) para formar una halohidrina como se muestra a continuación.
R 2 C=CR 2 + X 2 + H 2 O —— > R 2 C OH -CR 2 X
También hay otros reactivos que contienen halógeno que se suman a los dobles enlaces, como los ácidos hipohalosos, HOX y cloruros de sulfenilo, RsCl. Estos reactivos son asimétricos, por lo que su adición a dobles enlaces asimétricos puede tener lugar en principio de dos maneras. En la práctica, estas reacciones de adición son regioselectivas, favoreciéndose uno de los dos posibles productos constitucionalmente isoméricos. El resto electrófilo en ambos reactivos es el halógeno.
(CH 3) 2 C=CH 2 + HOBr —— > (CH 3) 2 C OH -CH 2 Br
(CH 3) 2 C=CH 2 + C 6 H 5 SCl —— > (CH 3) 2 C Cl -CH 2 S C 6 H 5
Mecanismos explican la Regioselectividad
X 2 /H 2 O o X 2 /ROH: La regioselectividad de la formación de halohidrina a partir de una reacción de alqueno con un halógeno en un disolvente nucleófilo es análoga a la vía de oximercuración-desmercuración. La molécula halógena toma el papel de electrófilo aceptando electrones pi nucleofílicos del alqueno mientras simultáneamente forma un enlace con el otro carbono vinílico para crear un ion bromonio (o cloroio). La formación de iones bromonio (o cloronio) estabiliza la carga positiva y evita el reordenamiento de los carbocationes. El disolvente toma el papel del nucleófilo porque está presente es un porcentaje mucho mayor que el grupo lábil y reacciona con el carbono más sustituido del ion bromonio cíclico (o cloronio) para crear regioquímica. La estereoquímica de esta reacción es antiadición porque el disolvente se acerca al ion bromonio con orientación posterior para producir el producto de adición. Sin embargo, dado que la interacción del halógeno con el alqueno puede ocurrir desde arriba o por debajo, no hay control estereoquímico en esta reacción y se producirá una mezcla de enantiómeros cuando corresponda. El paso final de este mecanismo es una transferencia de protones a una molécula de agua solvente para neutralizar el producto de adición.
HOX o RsCl: La regioselectividad de las reacciones de ácidos hipohalosos y cloruro de sulfenilo puede explicarse por el mismo mecanismo que utilizamos para racionalizar la regla de Markovnikov. La unión de una especie electrófila al doble enlace de un alqueno se forma preferentemente para producir el carbocatión más estable (más altamente sustituido). Este intermedio debe entonces combinarse rápidamente con una especie nucleofílica para producir el producto de adición.
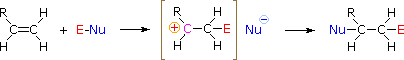
Para aplicar este mecanismo necesitamos determinar el resto electrófilo en cada uno de los reactivos. Mediante el uso de diferencias de electronegatividad podemos diseccionar reactivos de adición comunes en grupos electrófilos y nucleofílicos, como se muestra a la derecha. En el caso de los ácidos hipoclorosos e hipobromosos (HOX), estos ácidos débiles de Brønsted (pKa ca. 8) no reaccionan como donantes de protones; y dado que el oxígeno es más electronegativo que el cloro o el bromo, el electrófilo será un catión haluro. La especie nucleofílica que se une al carbocatión intermedio es entonces el ion hidróxido, o más probablemente agua (el disolvente habitual para estos reactivos), y los productos se denominan halohidrinas. Los cloruros de sulfenilo se agregan de manera opuesta porque el electrófilo es un catión azufre, RS (+), mientras que el resto nucleofílico es anión cloruro (el cloro es más electronegativo que el azufre).
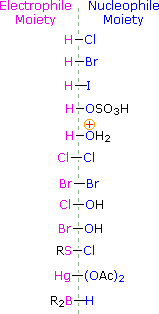
A continuación se presentan algunos ejemplos que ilustran la adición de diversos reactivos halógenos electrófilos a grupos alqueno. Observe la regioquímica específica de los productos, como se explicó anteriormente.
Ejercicio
1. Predecir el producto de la siguiente reacción:

2. Cuando el buteno se trata con NBS en presencia de agua, el producto muestra que el bromo está en el carbono menos sustituido, ¿es éste Markovnikov o anti-Markovnikov?
- Contestar
-
1.

2. Dado que el bromo es la primera adición al alqueno, esta adición sería una adición anti-Markovnikov.
Colaboradores
Prof. Steven Farmer (Sonoma State University)
William Reusch, Professor Emeritus (Michigan State U.), Virtual Textbook of Organic Chemistry

