10.3: Reacciones de alquinos - Adición de HX y X₂
- Page ID
- 75974
Objetivo de aprendizaje
- predecir los productos y especificar los reactivos para las Reacciones de Adición Electrofílica (EAR) de alquinos con HX y X 2
Adición por Reactivos Electrofílicos
Dado que la transformación química más común de un doble enlace carbono-carbono es una reacción de adición, podríamos esperar que lo mismo sea cierto para los enlaces triples carbono-carbono. De hecho, la mayoría de las reacciones de adición de alquenos también tienen lugar con alquinos con regio- y estereoselectividad similares.
Cuando se estudian las reacciones de adición de reactivos electrofílicos, como ácidos fuertes de Brønsted y halógenos, a alquinos encontramos una curiosa paradoja. Las reacciones son aún más exotérmicas que las adiciones a los alquenos, y sin embargo la velocidad de adición a los alquinos es más lenta por un factor de 100 a 1000 que la adición a alquenos equivalentemente sustituidos. La reacción de un equivalente de bromo con 1-penten-4-ino, por ejemplo, dio 4,5-dibromo-1-pentino como producto principal.
HC=C-CH 2 -CH=CH 2 + Br 2 → HC=C-CH 2 -CH Br CH 2 Br
Aunque estas adiciones electrofílicas a los alquinos son lentas, sí tienen lugar y generalmente muestran regioselectividad y antiestereoselectividad de la Regla de Markovnikov. Un problema, por supuesto, es que los productos de estas adiciones son ellos mismos alquenos sustituidos y, por lo tanto, pueden sufrir adiciones adicionales. Debido a su alta electronegatividad, los sustituyentes halógenos en un doble enlace actúan para reducir su nucleofilia y, por lo tanto, disminuir la tasa de reacciones de adición electrófila. En consecuencia, existe un delicado equilibrio en cuanto a si el producto de una adición inicial a un alquino sufrirá adición adicional a un producto saturado. Aunque los productos alquenos iniciales a menudo pueden aislarse e identificarse, comúnmente están presentes en mezclas de productos y pueden no obtenerse con alto rendimiento. Las siguientes reacciones ilustran muchas de estas características. En el último ejemplo, el 1,2-diodoeteno no sufre adición adicional en la medida en que los diyodoalcanos vecinales son relativamente inestables.
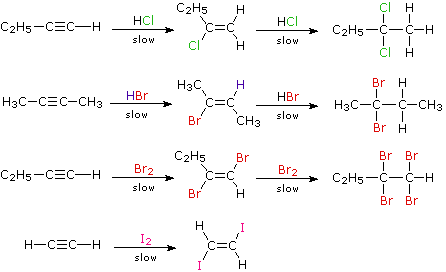
Como regla general, las reacciones de adición electrófila a alquenos y alquinos proceden por la formación inicial de un complejo p, en el que el electrófilo acepta electrones y se une débilmente al enlace múltiple. Dichos complejos se forman reversiblemente y luego pueden reorganizarse a un intermedio reactivo en una etapa más lenta que determina la velocidad. Las reacciones con alquinos son más sensibles a los cambios de disolventes y a las influencias catalíticas que los alquenos equivalentes.
¿Por qué las reacciones de los alquinos con reactivos electrofílicos son más lentas que las reacciones correspondientes de los alquenos? Después de todo, las reacciones de adición a alquinos son generalmente más exotérmicas que las adiciones a alquenos, y parecería haber una mayor densidad de electrones p alrededor del triple enlace (dos enlaces π versus uno). Dos factores son significativos para explicar esta aparente paradoja. En primer lugar, aunque hay más electrones π asociados con el triple enlace, los carbonos hibridados sp ejercen una fuerte atracción por estos electrones π, que en consecuencia están unidos más estrechamente al grupo funcional que los electrones π de un doble enlace. Esto se ve en los potenciales de ionización de etileno y acetileno.
| Acetileno | HC=CH + Energía → [HC=CH • (+) + e (—) | ΔH = +264 kcal/mol | |
|---|---|---|---|
| Etileno | H 2 C=CH 2 + Energía → [H 2 C=CH 2] • (+) + e (—) | ΔH = +244 kcal/mol | |
| Etano | H 3 C—CH 3 + Energía → [H 3 C—CH 3] • (+) + e (—) | ΔH = +296 kcal/mol |
Según lo definido por las ecuaciones anteriores, un potencial de ionización es la energía mínima requerida para eliminar un electrón de una molécula de un compuesto. Dado que los electrones p están menos apretados que los electrones sigma, esperamos que los potenciales de ionización del etileno y el acetileno sean menores que los del etano, como es el caso. Las afinidades de protones en fase gaseosa muestran el mismo orden, siendo el etileno más básico que el acetileno y el etano menos básico que cualquiera de ellos. Dado que la interacción inicial entre un electrófilo y un alqueno o alquino es la formación de un complejo p, en el que el electrófilo acepta electrones y se une débilmente al enlace múltiple, las reacciones relativamente más lentas de los alquinos se vuelven comprensibles.
Se presume que un segundo factor es la estabilidad del carbocatión intermedio generado por el enlace sigma de un protón u otro electrófilo a uno de los átomos de carbono de triple enlace. Este intermedio tiene su carga positiva localizada en un carbono insaturado, y dichos cationes vinílicos son menos estables que sus análogos saturados. De hecho, podemos modificar nuestro orden anterior de estabilidad de carbocationes para incluir estos cationes vinílicos de la manera que se muestra a continuación. Es posible que los cationes vinílicos estabilizados por conjugación con un sustituyente arilo sean intermedios en HX además de alquinos del tipo Ar-Cº C-R, pero tales intermedios no se forman en todas las reacciones de adición de alquinos.
|
La aplicación del postulado de Hammond indica que la energía de activación para la generación de un intermedio de catión vinílico sería mayor que la de un intermedio de menor energía. Esto se ilustra para alquenos versus alquinos mediante los siguientes diagramas de energía.
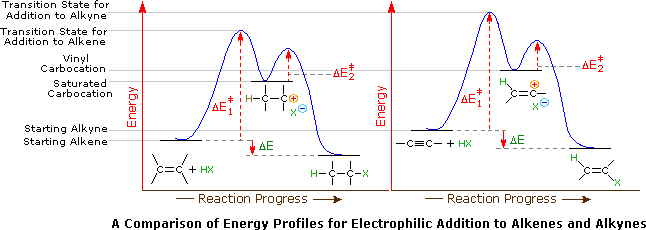
A pesar de estas diferencias, las adiciones electrofílicas a alquinos han surgido como transformadas sintéticas excepcionalmente útiles.
Adición de haluro de hidrógeno a un alquino
Resumen: Orden de reactividad de haluros de hidrógeno: HI > HB r> HCl > HF.
Sigue la regla de Markovnikov:
- El hidrógeno se suma al carbono con mayor número de hidrógenos, el halógeno se suma al carbono con menor cantidad de hidrógenos.
- La protinación ocurre en el carbocatión más estable. Con la adición de HX, se forman haloalquenos.
- Con la adición de exceso de HX, obtienes anti adición formando un dihaloalcano geminal.
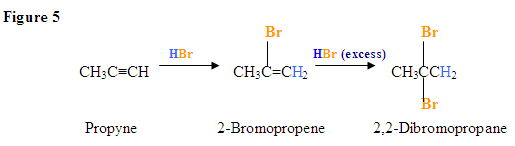
Adición de un HX a un alquino interno
Como se muestra en la Figura 2 a continuación,\(\pi\) los electrones reaccionan con el hidrógeno del HBr y debido a que los carbonos de alquino son equivalentes no importa qué carbono añade el hidrógeno. Una vez que el hidrógeno está unido covalentemente a uno de los carbonos, el bromuro reaccionará con el intermedio de carbocatión para formar un haluro de vinilo como se muestra en el ejemplo de formación de 2-bromobuteno a partir de 2-butino que reacciona con HBr. La reacción a continuación asume una relación molar 1:1 del alquino y HBr.
.bmp)
Ahora bien, ¿qué pasa si hay exceso de HBr?
La adición debido al exceso de HX produce un dihaloalcano geminal
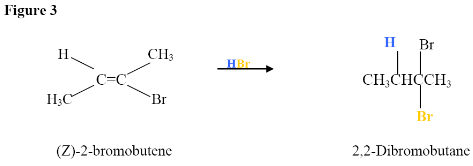
Aquí, la adición electrófila procede con los mismos pasos utilizados para lograr el producto en Adición de un HX a un Alquino Interno. \(\pi\)Los electrones reaccionan con el hidrógeno (mostrado en azul) añadiéndolo al carbono de la izquierda porque los electrones de par solitario del bromo pueden ayudar a estabilizar el carbocatión intermedio que reacciona con los iones bromuro para formar un dihaluro geminal.
Adición de HX al alquino terminal
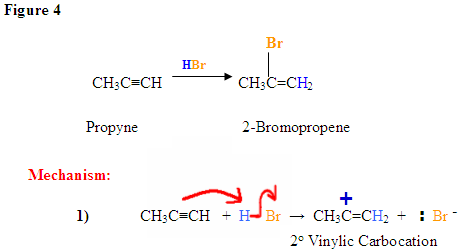
Para los alquinos terminales, los átomos de carbono que comparten el triple enlace no son equivalentes. La adición de HX a alquinos terminales ocurre de manera Markovnikov en la que el haluro se une al carbono más sustituido. Los electrones pi reaccionan con el hidrógeno y se une al carbono terminal. El bromuro reacciona con el carbocatión intermedio resultante para formar el haluro de vinilo. La reacción general y el mecanismo se muestran a continuación.
Adición por exceso de HBr presente
Similar a la adición de exceso de HBr a alquinos internos, ambos haluros se agregarán al mismo carbono para formar un dihaluro geminal.
Adición de HBr con mecanismo radical
La mayoría de las reacciones de haluro de hidrógeno con alquinos terminales ocurren de manera Markovnikov en la que el haluro se une al carbono más sustituido ya que es el más polarizado positivamente. Sin embargo, hay dos reacciones específicas entre alquinos donde se producen reacciones anti-Markovnikov: la adición radical de HBr y las reacciones de oxidación de hidroboración. Para los alquinos, se lleva a cabo una adición anti-Markovnikov para alquinos terminales.
El Br del Bromuro de Hidrógeno (H-Br) se une al 1-carbono menos sustituido del alquino terminal que se muestra a continuación de manera anti-Markovnikov mientras que el protón de hidrógeno se une al segundo carbono. Como se mencionó anteriormente, el primer carbono es el carbono menos sustituido ya que tiene menos enlaces unidos a carbonos y otros sustituyentes. El reactivo H-Br también debe hacerse reaccionar con calor o algún otro iniciador radicial como un peróxido para que esta reacción proceda de esta manera. Esta presencia del radical o calor conduce a la adición anti-Markovnikov ya que produce la reacción más estable.
El producto de un alquino terminal que se hace reaccionar con un peróxido (o luz) y H-Br es un 1-bromoalqueno.
Regioselectividad: El bromo puede unirse de manera syn o anti lo que significa que el alqueno resultante puede ser tanto cis como tran s. La adición de Syn es cuando ambos Hidrógenos se unen a la misma cara o lado del doble enlace (es decir, cis) mientras que la adición anti es cuando se unen en lados opuestos del enlace (trans).
.jpg)
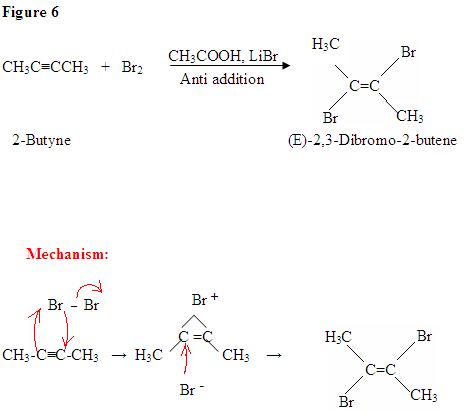
Halogenación de alquinos
La adición de X 2 a los alquinos es análoga a la adición de X2 a los alquenos. La molécula halógena se polariza por la aproximación del alquino nucleofílico. Los electrones pi del alquino reaccionan con el bromo para formar un enlace carbono-bromo y un ion halonio cíclico con haluro como grupo saliente. La formación del ion halonio cíclico requiere la antiadición del haluro nucleofílico para producir un dihaluro alqueno vecinal como se muestra en la reacción a continuación.
Ejercicio
- Dibujar la estructura, y dar el nombre de la IUPAC, del producto formado en cada una de las reacciones enumeradas a continuación.
- $\ ce {\ sf {CH3-C #C -CH3-> [\ displaystyle {\ textrm {1 equiv}}] [\ displaystyle {\ textrm {HCl}}]}} $
- $\ ce {\ sf {CH3-C #C -CH3-> [\ displaystyle {\ textrm {exceso}}] [\ displaystyle {\ textrm {HCl}}]}} $
- $\ ce {\ sf {CH3-C #C -CH3-> [\ displaystyle {\ textrm {1 equiv}}] [\ displaystyle {\ textrm {Br} _2}]}} $
- $\ ce {\ sf {CH3-C #C -CH3-> [\ displaystyle {\ textrm {exceso}}] [\ displaystyle {\ textrm {Br} _2}]}} $
- $\ ce {\ sf {CH3CH2-C #C -H-> [\ displaystyle {\ textrm {1 equiv}}] [\ displaystyle {\ textrm {HCl}]}} $
- $\ ce {\ sf {CH3CH2-C #C -H-> [\ displaystyle {\ textrm {exceso}}] [\ displaystyle {\ textrm {HCl}]}} $
- $\ ce {\ sf {CH3CH2CH2-C #C -H-> [\ displaystyle {\ textrm {1 equiv}}] [\ displaystyle {\ textrm {Br} _2}]}} $
- $\ ce {\ sf {CH3CH2CH2-C #C -H-> [\ displaystyle {\ textrm {exceso}}] [\ displaystyle {\ textrm {Br} _2}]}} $
- Responder
-
-
(Z) -2-cloro-2-buteno
-
2,2-diclorobutano
-
(E) -2,3-dibromo-2-buteno
-
2,2,3,3-tetrabromobutano
-
2-cloro-1-buteno
-
2,2-diclorobutano
-
(E) -1,2-dibromo-1-penteno
-
1,1,2,2-tetrabromopentano
-
Colaboradores y Atribuciones
Dr. Dietmar Kennepohl FCIC (Professor of Chemistry, Athabasca University)
Prof. Steven Farmer (Sonoma State University)
William Reusch, Professor Emeritus (Michigan State U.), Virtual Textbook of Organic Chemistry
Organic Chemistry With a Biological Emphasis by Tim Soderberg (University of Minnesota, Morris)
Jim Clark (Chemguide.co.uk)

