11.7: Espectrometría de Masas - una introducción
- Page ID
- 76704
Objetivos de aprendizaje
Después de completar esta sección, deberías poder
- bosquejar un diagrama simple para mostrar las características esenciales de un espectrómetro de masas.
- identificar picos en un espectro de masas simple y explicar cómo surgen.
Términos Clave
Asegura que puedes definir, y usar en contexto, los términos clave a continuación.
- pico parental (pico de iones moleculares)
- abundancia relativa
- espectroscopía de masas
- iones moleculares (M+·)
- Relación masa/carga (m/z)
Notas de estudio
Quizás recuerdes de la química general de primer año cómo se ha utilizado la espectroscopia de masas para establecer la masa atómica y la abundancia de isótopos.
Los espectrómetros de masas son grandes y caros, y generalmente son operados únicamente por personal completamente capacitado, por lo que no tendrá la oportunidad de utilizar dicho instrumento como parte de este curso. Los químicos de investigación a menudo dependen bastante de los espectros de masas para ayudarlos en la identificación de compuestos, y se le requerirá que interprete espectros de masas simples tanto en asignaciones como en exámenes. Nótese que en la mayoría de los intentos de identificar un compuesto desconocido, los químicos no se basan exclusivamente en los resultados obtenidos de una sola técnica espectroscópica. Generalmente se emplea una combinación de propiedades químicas y físicas y evidencia espectral.
El espectrómetro de masas
Para medir las características de las moléculas individuales, un espectrómetro de masas las convierte en iones para que puedan ser movidas y manipuladas por campos eléctricos y magnéticos externos. Las tres funciones esenciales de un espectrómetro de masas, y los componentes asociados, son:
- Los iones se clasifican y separan según su masa y carga. El analizador de masas
- Luego se miden los iones separados y los resultados se muestran en un gráfico. El Detector
Debido a que los iones son muy reactivos y de corta duración, su formación y manipulación deben realizarse en vacío. La presión atmosférica es de alrededor de 760 torr (mm de mercurio). La presión bajo la cual se pueden manejar los iones es aproximadamente de 10 -5 a 10 -8 torr (menos de una billonésima parte de una atmósfera). Cada una de las tres tareas enumeradas anteriormente se puede realizar de diferentes maneras. En un procedimiento común, la ionización se efectúa mediante un haz de electrones de alta energía, y la separación de iones se logra acelerando y enfocando los iones en un haz, que luego es doblado por un campo magnético externo. Luego, los iones se detectan electrónicamente y la información resultante se almacena y analiza en una computadora. Un espectrómetro de masas que opera de esta manera se describe en el siguiente diagrama. El corazón del espectrómetro es la fuente de iones. Aquí las moléculas de la muestra (puntos negros) son bombardeadas por electrones (líneas azul claro) que salen de un filamento calentado. Esto se llama fuente EI (electrón-impacto). Se permite que los gases y las muestras de líquidos volátiles se fuguen a la fuente de iones desde un depósito (como se muestra). Los sólidos y líquidos no volátiles pueden introducirse directamente. Los cationes formados por el bombardeo de electrones (puntos rojos) son empujados hacia fuera por una placa repelente cargada (los aniones son atraídos hacia ella), y se aceleran hacia otros electrodos, teniendo ranuras a través de las cuales los iones pasan como un haz. Algunos de estos iones se fragmentan en cationes más pequeños y fragmentos neutros. Un campo magnético perpendicular desvía el haz de iones en un arco cuyo radio es inversamente proporcional a la masa de cada ion. Los iones más ligeros son desviados más que los iones más pesados. Al variar la intensidad del campo magnético, los iones de diferente masa pueden enfocarse progresivamente en un detector fijado al final de un tubo curvo (también bajo un alto vacío).
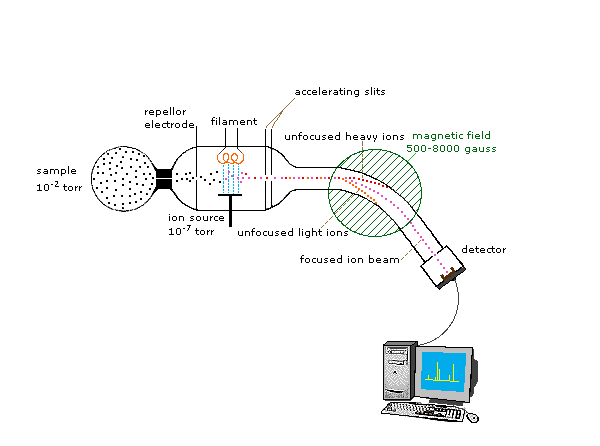
Cuando un electrón de alta energía choca con una molécula, a menudo la ioniza al derribar uno de los electrones moleculares (ya sea de unión o no unión). Esto deja atrás un ion molecular (coloreado de rojo en el siguiente diagrama). La energía residual de la colisión puede hacer que el ion molecular se fragmente en trozos neutros (de color verde) e iones fragmentos más pequeños (de color rosa y naranja). El ion molecular es un catión radical, pero los iones fragmentos pueden ser cationes radicales (rosa) o carbocationes (naranja), dependiendo de la naturaleza del fragmento neutro. Aparecerá una visualización animada de este proceso de ionización si hace clic en la fuente de iones del diagrama del espectrómetro de masas.
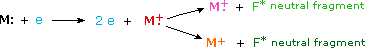
A continuación se muestra la salida típica para un experimento de MS de ionización electrónica (los datos de MS a continuación se derivan de la base de datos espectral para compuestos orgánicos, un servicio gratuito basado en la web proporcionado por AIST en Japón.
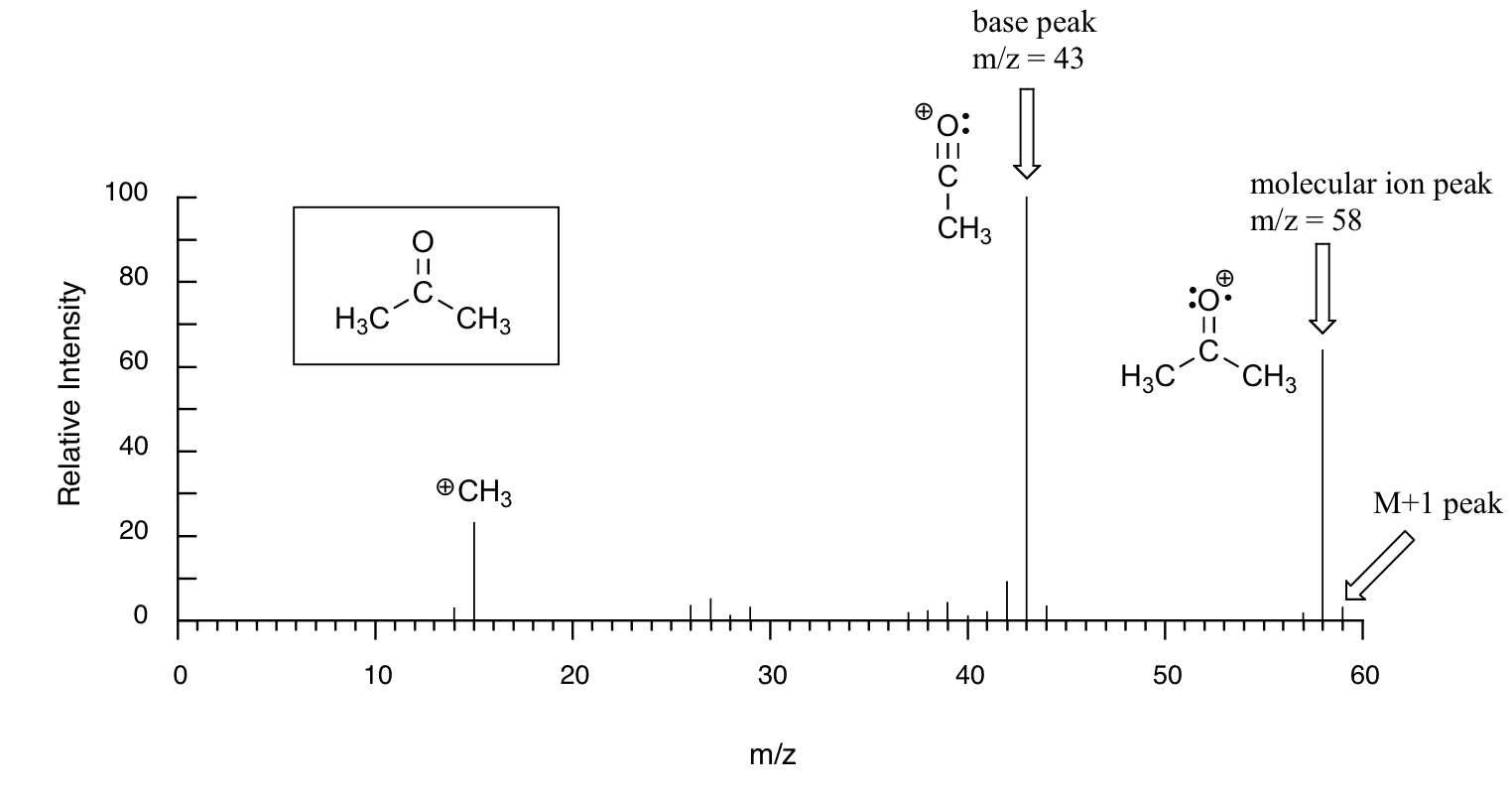
La muestra es acetona. En el eje horizontal está el valor para m/z (como señalamos anteriormente, la carga z es casi siempre +1, por lo que en la práctica esto es lo mismo que la masa). En el eje vertical se encuentra la abundancia relativa de cada ion detectado. En esta escala, el ion más abundante, llamado pico base, se establece en 100%, y todos los demás picos se registran en relación con este valor. Para la acetona, el pico base corresponde a un fragmento con m/z = 43 -. El peso molecular de la acetona es 58, por lo que podemos identificar el pico a m/z = 58 como el correspondiente al pico de iones moleculares, o pico parental. Observe que hay un pequeño pico a m/z = 59: esto se conoce como el pico M+1. ¿Cómo puede haber un ion que tenga una masa mayor que el ion molecular? Simple: una pequeña fracción -aproximadamente 1.1%- de todos los átomos de carbono en la naturaleza son en realidad el isótopo 13 C en lugar del 12 C. El isótopo 13 C es, por supuesto, más pesado que 12 C por 1 unidad de masa. Además, aproximadamente 0.015% de todos los átomos de hidrógeno son en realidad deuterio, el isótopo 2H. Entonces el pico M+1 representa aquellas pocas moléculas de acetona en la muestra que contenían ya sea un 13 C o 2 H.
Colaboradores
Prof. Steven Farmer (Sonoma State University)
William Reusch, Professor Emeritus (Michigan State U.), Virtual Textbook of Organic Chemistry

