11.9: Patrones útiles para la elucidación de estructuras
- Page ID
- 76752
La naturaleza de los espectros de masas
Un espectro de masas generalmente se presentará como un gráfico de barras vertical, en el que cada barra representa un ion que tiene una relación masa-carga específica (m/z) y la longitud de la barra indica la abundancia relativa del ion. Al ion más intenso se le asigna una abundancia de 100, y se le conoce como el pico base. La mayoría de los iones formados en un espectrómetro de masas tienen una sola carga, por lo que el valor m/z es equivalente a la masa misma. Los espectrómetros de masas modernos distinguen fácilmente (resuelven) iones que difieren en una sola unidad de masa atómica y, por lo tanto, proporcionan valores completamente precisos para la masa molecular de un compuesto. El ion de mayor masa en un espectro normalmente se considera el ion molecular, y los iones de menor masa son fragmentos del ion molecular, asumiendo que la muestra es un solo compuesto puro.
La masa atómica se da en términos de la unidad de masa atómica unificada (símbolo: μ) o dalton (símbolo: Da). En los últimos años se ha producido un cambio gradual hacia el uso del dalton en preferencia a la unidad unificada de masa atómica. El dalton se clasifica como una “unidad no SI cuyos valores en unidades SI deben obtenerse experimentalmente”. Se define como una doceava parte de la masa restante de un átomo no unido de carbono-12 en su estado básico nuclear y electrónico, y tiene un valor de 1.660538782 (83) x10 -27 kg.
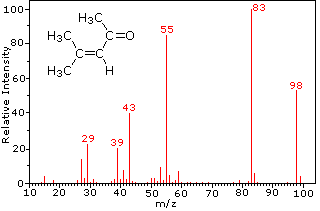
El siguiente diagrama muestra los espectros de masas de tres compuestos gaseosos simples, dióxido de carbono, propano y ciclopropano. Las moléculas de estos compuestos son similares en tamaño, CO 2 y C 3 H 8 ambos tienen una masa nominal de 44 Da, y C 3 H 6 tiene una masa de 42 Da. El ion molecular es el ion más fuerte en los espectros de CO 2 y C 3 H 6, y es moderadamente fuerte en propano. La resolución de masa unitaria es fácilmente evidente en estos espectros (obsérvese la separación de iones que tienen m/z=39, 40, 41 y 42 en el espectro del ciclopropano). A pesar de que estos compuestos son muy similares en tamaño, es sencillo identificarlos a partir de sus espectros de masas individuales. Al hacer clic en cada espectro por turno, se mostrará un análisis de fragmentación parcial y asignación de picos. Incluso con compuestos simples como estos, cabe señalar que rara vez es posible explicar el origen de todos los iones fragmentos en un espectro. Además, la estructura de la mayoría de los iones fragmentos rara vez se conoce con certeza.
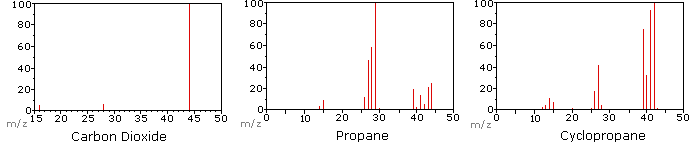
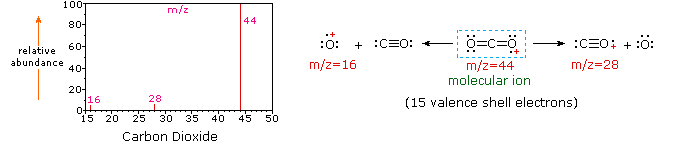
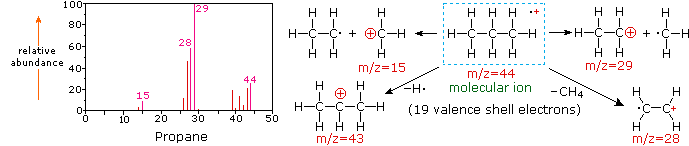
Dado que una molécula de dióxido de carbono está compuesta por sólo tres átomos, su espectro de masas es muy sencillo. El ion molecular es también el pico base, y los únicos iones fragmentos son CO (m/z=28) y O (m/z=16). El ion molecular del propano también tiene m/z=44, pero no es el ion más abundante en el espectro. La escisión de un enlace carbono-carbono da fragmentos de metilo y etilo, uno de los cuales es un carbocatión y el otro un radical. Se observan ambas distribuciones, pero el catión etílico mayor (m/z=29) es el más abundante, posiblemente debido a que su tamaño proporciona mayor dispersión de carga. Una escisión de enlace similar en el ciclopropano no da dos fragmentos, por lo que el ion molecular es más fuerte que en el propano, y de hecho es responsable del pico base. La pérdida de un átomo de hidrógeno, ya sea antes o después de la apertura del anillo, produce el catión alilo estable (m/z=41). El tercer ion más fuerte del espectro tiene m/z=39 (C 3 H 3). Su estructura es incierta, pero en el diagrama se muestran dos posibilidades. El pequeño ion m/z=39 en propano y la ausencia de un ion m/z=29 en el ciclopropano son particularmente significativos para distinguir estos hidrocarburos.
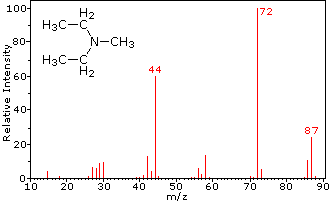
La mayoría de los compuestos orgánicos estables tienen un número par de electrones totales, lo que refleja el hecho de que los electrones ocupan orbitales atómicos y moleculares en pares. Cuando se elimina un solo electrón de una molécula para dar un ion, el recuento total de electrones se convierte en un número impar, y nos referimos a tales iones como cationes radicales. El ion molecular en un espectro de masas es siempre un catión radical, pero los iones fragmentos pueden ser cationes pares de electrones o cationes de radicales de electrones impares, dependiendo del fragmento neutro perdido. Las fragmentaciones más simples y comunes son las escisiones de enlace que producen un radical neutro (número impar de electrones) y un catión que tiene un número par de electrones. Una fragmentación menos común, en la que se pierde un fragmento neutro de electrones pares, produce un ion fragmento de catión radical de electrones impares. Los propios iones fragmentos pueden fragmentarse aún más. Como regla general, los iones de electrones impares pueden fragmentarse en iones de electrones impares o pares, pero los iones de electrones pares se fragmentan solo en otros iones de electrones pares. Las masas de iones moleculares y fragmentos también reflejan el recuento de electrones, dependiendo del número de átomos de nitrógeno en la especie.
|
Iones sin nitrógeno |
masa de |
masa de |
|---|---|---|
|
Iones que tienen un número |
masa de |
masa de |
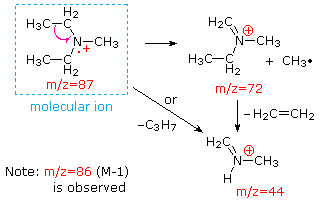
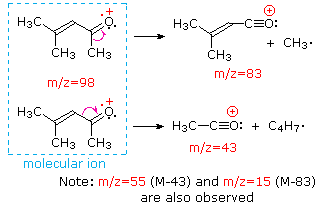
Esta distinción se ilustra muy bien con los siguientes dos ejemplos. La cetona insaturada, 4-metil-3-penteno-2-ona, a la izquierda no tiene nitrógeno por lo que la masa del ión molecular (m/z = 98) es un número par. La mayoría de los iones fragmentos tienen masas impares y, por lo tanto, son cationes pares de electrones. La dietilmetilamina, por otro lado, tiene un nitrógeno y su masa molecular (m/z = 87) es un número impar. La mayoría de los iones fragmentos tienen masas pares (iones a m/z = 30, 42, 56 y 58 no están marcados), y son cationes de nitrógeno de electrones pares. Los iones débiles de electrones pares a m/z=15 y 29 se deben a cationes metilo y etilo (sin átomos de nitrógeno). Las fragmentaciones que conducen a los iones de fragmentos principales se mostrarán haciendo clic en el espectro apropiado. Los clics repetidos harán un ciclo de la pantalla.
|
 |
|
|
|
4-metil-3-penteno-2-ona |
N, N-dietilmetilamina |
|---|
Cuando los pares de electrones no enlazados están presentes en una molécula (por ejemplo, en N u O), las vías de fragmentación a veces pueden explicarse asumiendo que el electrón faltante está parcialmente localizado en ese átomo. Algunos de esos mecanismos se muestran arriba. La escisión de enlaces genera un radical y un catión, y ambos fragmentos suelen compartir estos roles, aunque de manera desigual.
Isótopos
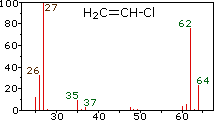
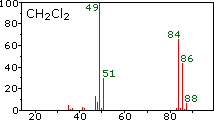
Dado que un espectrómetro de masas separa y detecta iones de masas ligeramente diferentes, distingue fácilmente diferentes isótopos de un elemento dado. Esto se manifiesta de manera más dramática para compuestos que contienen bromo y cloro, como se ilustra mediante los siguientes ejemplos. Dado que las moléculas de bromo tienen solo dos átomos, el espectro de la izquierda vendrá como una sorpresa si se asume una sola masa atómica de 80 Da para el Br. Los cinco picos de este espectro demuestran claramente que el bromo natural consiste en una mezcla casi 50:50 de isótopos que tienen masas atómicas de 79 y 81 Da respectivamente. Así, la molécula de bromo puede estar compuesta por dos 79 átomos de Br (masa 158 Da), dos 81 átomos de Br (masa 162 Da) o la combinación más probable de 79 Br- 81 Br (masa 160 Da). La fragmentación de Br 2 a un catión bromo da lugar entonces a picos de iones de igual tamaño a 79 y 81 Da.
 |
 |
 |
||
|
bromo |
cloruro de vinilo |
cloruro de metileno |
|---|
Los espectros centro y derecho muestran que el cloro también está compuesto por dos isótopos, el más abundante tiene una masa de 35 Da, y el isótopo menor una masa 37 Da. La composición isotópica precisa del cloro y el bromo es:
- Cloro: 75.77% 35 Cl y 24.23% 37 Cl
- Bromo: 50.50% 79 Br y 49.50% 81 Br
La presencia de cloro o bromo en una molécula o ion se detecta fácilmente al notar las relaciones de intensidad de los iones que difieren en 2 Da. En el caso del cloruro de metileno, el ión molecular consiste en tres picos a m/z=84, 86 y 88 Da, y sus intensidades decrecientes pueden calcularse a partir de las abundancias naturales dadas anteriormente. La pérdida de un átomo de cloro da dos iones fragmentos isotópicos a m/z=49 y 51 Da, incorporando claramente un solo átomo de cloro. El flúor y el yodo, por el contrario, son monoisotópicos, teniendo masas de 19 Da y 127 Da respectivamente. Cabe señalar que la presencia de átomos de halógeno en una molécula o fragmento de ion no cambia las reglas de masa impares dadas anteriormente.
Para hacer uso de una calculadora que predice los cúmulos de isótopos para diferentes combinaciones de cloro, bromo y otros elementos Haga clic aquí. Esta aplicación fue desarrollada en Colby College.
|
||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
Otros dos elementos comunes que tienen firmas de isótopos útiles son el carbono, 13 C es 1.1% de abundancia natural y el azufre, 33 S y 34 S son 0.76% y 4.22% de abundancia natural respectivamente. Por ejemplo, el pequeño pico m/z=99 Da en el espectro de 4-metil-3-penteno-2-ona (arriba) se debe a la presencia de un solo átomo de 13 C en el ión molecular. Aunque menos importantes en este sentido, 15 N y 18 O también hacen pequeñas contribuciones a satélites de mayor masa de iones moleculares que incorporan estos elementos.
La calculadora de la derecha puede ser utilizada para calcular las contribuciones de isótopos a abundancias de iones 1 y 2 Da mayores que el ion molecular (M). Simplemente ingrese un número de subíndice apropiado a la derecha de cada símbolo, dejando esos elementos no presentes en blanco, y presione el botón "Calcular”. Los números mostrados en los cuadros M+1 y M+2 son relativos a M que se establece en 100%.
Patrones de fragmentación
La fragmentación de iones moleculares en una variedad de iones fragmentos es una bendición mixta. La naturaleza de los fragmentos a menudo proporciona una pista de la estructura molecular, pero si el ion molecular tiene una vida útil de menos de unos pocos microsegundos no sobrevivirá lo suficiente como para ser observado. Sin un pico de iones moleculares como referencia, la dificultad de interpretar un espectro de masas aumenta notablemente. Afortunadamente, la mayoría de los compuestos orgánicos dan espectros de masas que incluyen un ion molecular, y aquellos que no suelen responder con éxito al uso de condiciones de ionización más suaves. Entre los compuestos orgánicos simples, los iones moleculares más estables son los de anillos aromáticos, otros sistemas de electrones pi conjugados y cicloalcanos. Los alcoholes, éteres y alcanos altamente ramificados generalmente muestran la mayor tendencia hacia la fragmentación.
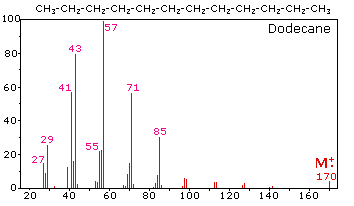
El espectro de masas del dodecano a la derecha ilustra el comportamiento de un alcano no ramificado. Dado que no hay heteroátomos en esta molécula, no hay electrones de capa de valencia no enlazante. En consecuencia, el carácter de catión radical del ion molecular (m/z = 170) se deslocaliza sobre todos los enlaces covalentes. La fragmentación de los enlaces C-C ocurre porque suelen ser más débiles que los enlaces C-H, y esto produce una mezcla de radicales alquilo y carbocationes de alquilo. La carga positiva reside comúnmente en el fragmento más pequeño, por lo que vemos una serie homóloga de cationes hexilo (m/z = 85), pentil (m/z = 71), butilo (m/z = 57), propilo (m/z = 43), etilo (m/z = 29) y metilo (m/z = 15). Estos van acompañados de un conjunto de carbocationes de alquenil correspondientes (e.g. m/z = 55, 41 y 27) formados por pérdida de 2 H. Todos los iones fragmentos significativos en este espectro son iones pares de electrones. En la mayoría de los espectros alcanos los iones propilo y butilo son los más abundantes.
La presencia de un grupo funcional, particularmente uno que tiene un heteroátomo Y con electrones de valencia no enlazantes (Y = N, O, S, X etc.), puede alterar drásticamente el patrón de fragmentación de un compuesto. Se cree que esta influencia ocurre debido a una “localización” del componente catión radical del ion molecular en el heteroátomo. Después de todo, es más fácil eliminar (ionizar) un electrón no enlazante que uno que forma parte de un enlace covalente. Al localizar el resto reactivo, se favorecerán ciertos procesos de fragmentación. Estos se resumen en el siguiente diagrama, donde la caja sombreada verde en la parte superior muestra ejemplos de tales iones moleculares “localizados”. Las dos primeras rutas de fragmentación conducen a iones pares de electrones, y la eliminación (ruta #3) da un ion de electrones impares. Tenga en cuenta el uso de diferentes flechas curvas para mostrar desplazamientos de electrones individuales en comparación con los desplazamientos de pares de electrones.
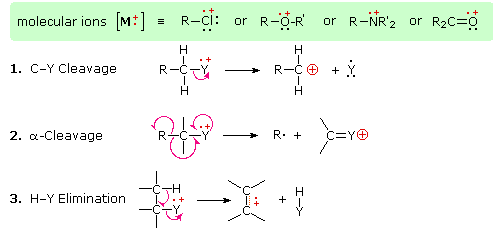
Las distribuciones de carga mostradas anteriormente son comunes, pero para cada proceso de escisión la carga a veces puede ser transportada por las otras especies (neutras), y se observan ambos iones fragmentos. De las tres reacciones de escisión aquí descritas, la escisión alfa es generalmente favorecida para compuestos de nitrógeno, oxígeno y azufre. De hecho, en los espectros previamente mostrados de 4-metil-3-penteno-2-ona y N, N-dietilmetilamina los iones fragmentos principales provienen de las escisiones alfa. Otros ejemplos de influencia de grupos funcionales en la fragmentación se proporcionan mediante una selección de compuestos que pueden examinarse haciendo clic en el botón izquierdo de abajo. Se pueden ver tablas útiles de iones fragmentos comunes y especies neutras haciendo clic en el botón derecho.
|
|
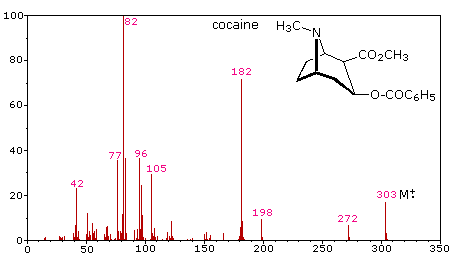
La complejidad de los patrones de fragmentación ha llevado a que los espectros de masas sean utilizados como “huellas” para identificar compuestos. Los contaminantes ambientales, los residuos de pesticidas en los alimentos y la identificación de sustancias controladas son solo algunos ejemplos de esta aplicación. Muestras extremadamente pequeñas de una sustancia desconocida (un microgramo o menos) son suficientes para dicho análisis. El siguiente espectro de masas de cocaína demuestra cómo un laboratorio forense podría determinar la naturaleza de una droga callejera desconocida. A pesar de que se ha producido una fragmentación extensa, muchos de los iones más abundantes (identificados por números magenta) pueden ser racionalizados por los tres mecanismos mostrados anteriormente. Las asignaciones plausibles se pueden ver haciendo clic en el espectro, y cabe señalar que todos son iones pares de electrones. El ion m/z = 42 podría ser cualquiera o todos los siguientes: C 3 H 6, C 2 H 2 O o C 2 H 4 N. Se podría hacer una asignación precisa a partir de un valor m/z de alta resolución (siguiente sección).
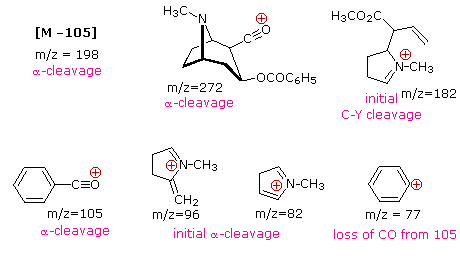
Los iones de fragmentos de electrones impares a menudo se forman por reordenamientos característicos en los que se pierden fragmentos neutros estables. Los mecanismos para algunos de estos reordenamientos se han identificado siguiendo el curso de los iones moleculares marcados isotópicamente. Algunos ejemplos de estos mecanismos de reordenamiento se pueden ver haciendo clic en el siguiente botón.
|
Ejercicio
7. ¿Cuáles son las masas de todos los componentes en las siguientes fragmentaciones?

- Contestar
-
7.