12.4: Espectroscopia de RMN 1H y equivalencia de protones
- Page ID
- 76662
Objetivos
Después de completar esta sección, deberías poder
- identificar aquellos protones que son equivalentes en una estructura química dada.
- utilizar el espectro de RMN 1H de un compuesto orgánico simple para determinar el número de conjuntos equivalentes de protones presentes.
Términos Clave
Asegúrese de que puede definir, y usar en contexto, los términos clave a continuación.
- diastereotópico
- enantiotópico
- homotópico
Notas de estudio
Es importante en esta etapa poder identificar protones equivalentes en cualquier compuesto orgánico dada la estructura de ese compuesto. Una vez que conoces el número de diferentes grupos de protones equivalentes en un compuesto, puedes predecir el número (antes del acoplamiento) y la fuerza relativa de las señales. Mira los siguientes ejemplos y asegúrate de entender cómo se deriva el número y la relación de intensidad de las señales a partir de la estructura mostrada.
| Estructura | Número de señales | Relación de señales | |
|---|---|---|---|
| CH 3 OCH 2 CH 2 Br | 3 | A: B: C | 3:2: 2 |
| 1 | |||
| 3 | A: B: C | 2:2: 6 (o 1:1: 3) | |
| 3 | A: B: C | 2:4: 2 (o 1:2: 1) | |
| 4 | A: B: C: D | 3:2: 2:3 | |
| 5 | A: B: C: D: E | 3:1: 1:1: 1 | |
Si todos los protones en todas las moléculas orgánicas tuvieran la misma frecuencia de resonancia en un campo magnético externo de una fuerza dada, la información del párrafo anterior sería interesante desde un punto de vista teórico, pero no sería terriblemente útil para los químicos orgánicos. Afortunadamente para nosotros, sin embargo, las frecuencias de resonancia no son uniformes para todos los protones en una molécula. En un campo magnético externo de una intensidad dada, los protones en diferentes ubicaciones de una molécula tienen diferentes frecuencias de resonancia, debido a que se encuentran en entornos electrónicos no idénticos. En el acetato de metilo, por ejemplo, hay dos 'conjuntos' de protones. Los tres protones etiquetados como Ha tienen una frecuencia de resonancia diferente -y fácilmente distinguible- que los tres protones H b, porque los dos conjuntos de protones están en ambientes no idénticos: son, en otras palabras, químicamente no equivalentes.

Por otra parte, los tres protones H a están todos en el mismo entorno electrónico, y son químicamente equivalentes entre sí. Tienen frecuencias de resonancia idénticas. Lo mismo puede decirse de los tres protones H b.
La capacidad de reconocer la equivalencia química y la no equivalencia entre los átomos en una molécula será fundamental para comprender la RMN. En cada una de las moléculas a continuación, todos los protones son químicamente equivalentes, y por lo tanto tendrán la misma frecuencia de resonancia en un experimento de RMN.
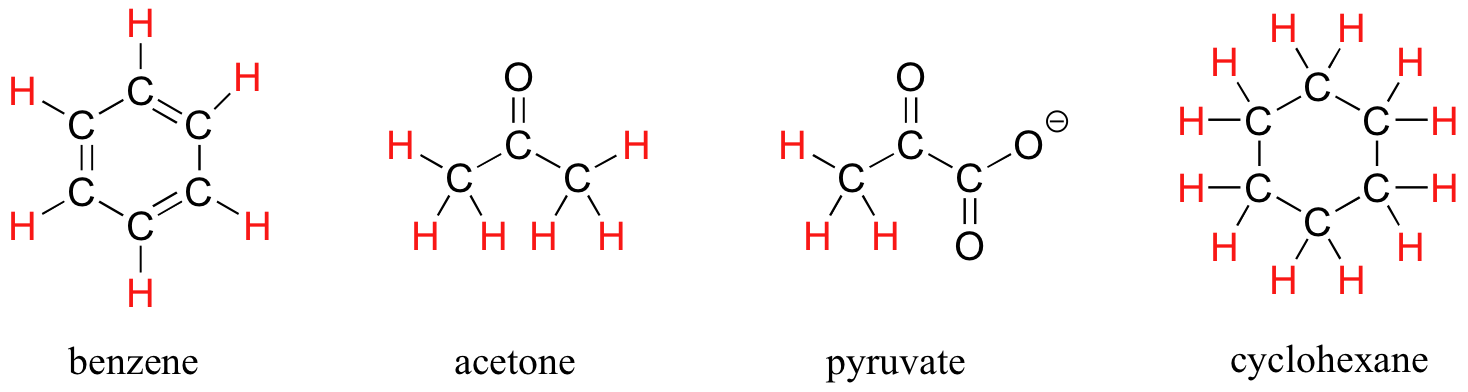
Se podría esperar que los hidrógenos equitoriales y axiales en ciclohexano no serían equivalentes, y tendrían diferentes frecuencias de resonancia. De hecho, un hidrógeno axial se encuentra en un entorno electrónico diferente al de un hidrógeno equitativa. Recuerde, sin embargo, que la molécula gira rápidamente entre sus dos conformaciones de silla, lo que significa que cualquier hidrógeno dado se mueve rápidamente de un lado a otro entre las posiciones equitoriales y axiales. Resulta que, excepto a temperaturas extremadamente bajas, este movimiento de rotación ocurre en una escala de tiempo que es mucho más rápida que la escala de tiempo de un experimento de RMN.
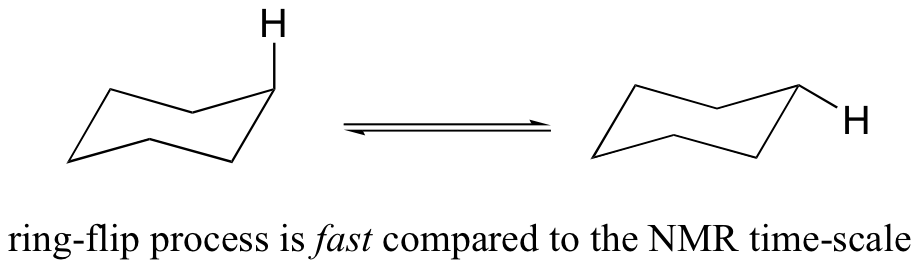
En este sentido, la RMN es como una cámara que toma fotografías de un objeto que se mueve rápidamente con una velocidad de obturación lenta; el resultado es una imagen borrosa. En términos de RMN, esto significa que los 12 protones en ciclohexano son equivalentes.
Cada una de las moléculas de la siguiente figura contiene dos conjuntos de protones, al igual que nuestro ejemplo anterior de acetato de metilo, y nuevamente en cada caso la frecuencia de resonancia de los protones H a será diferente de la de los protones H b.
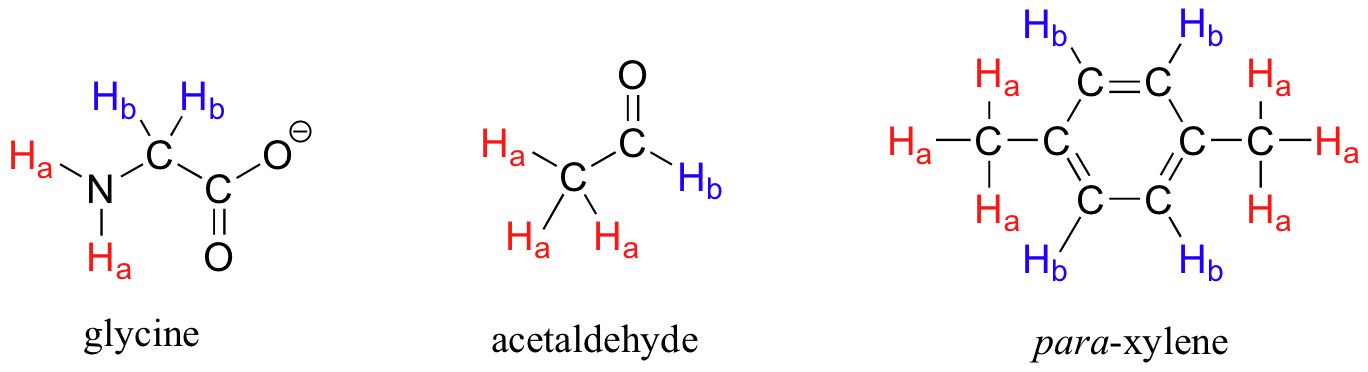
Observe cómo la simetría del para-xileno da como resultado que solo haya dos conjuntos diferentes de protones.
La mayoría de las moléculas orgánicas tienen varios conjuntos de protones en diferentes ambientes químicos, y cada conjunto, en teoría, tendrá una frecuencia de resonancia diferente en espectroscopía de 1H-RMN.
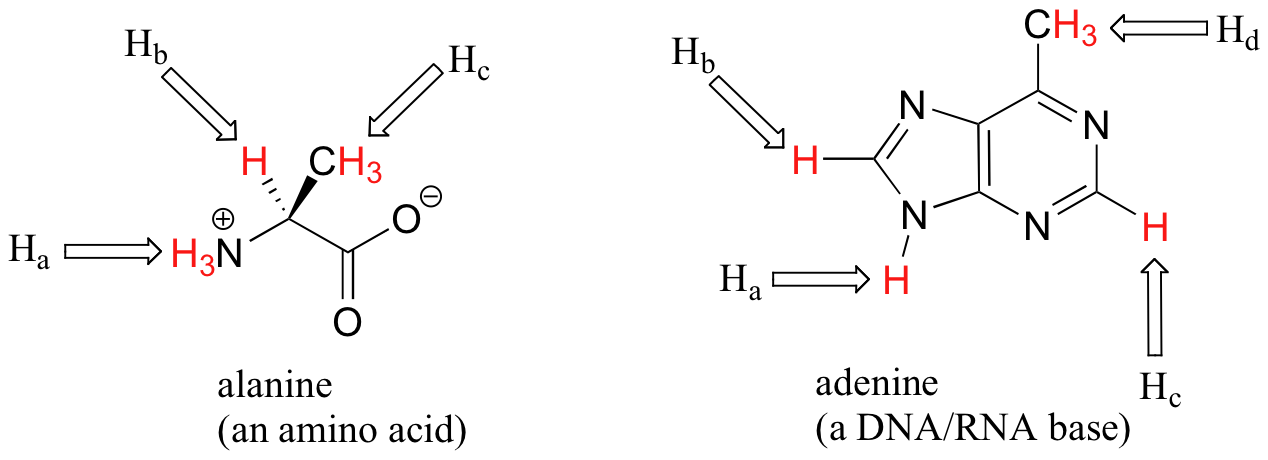
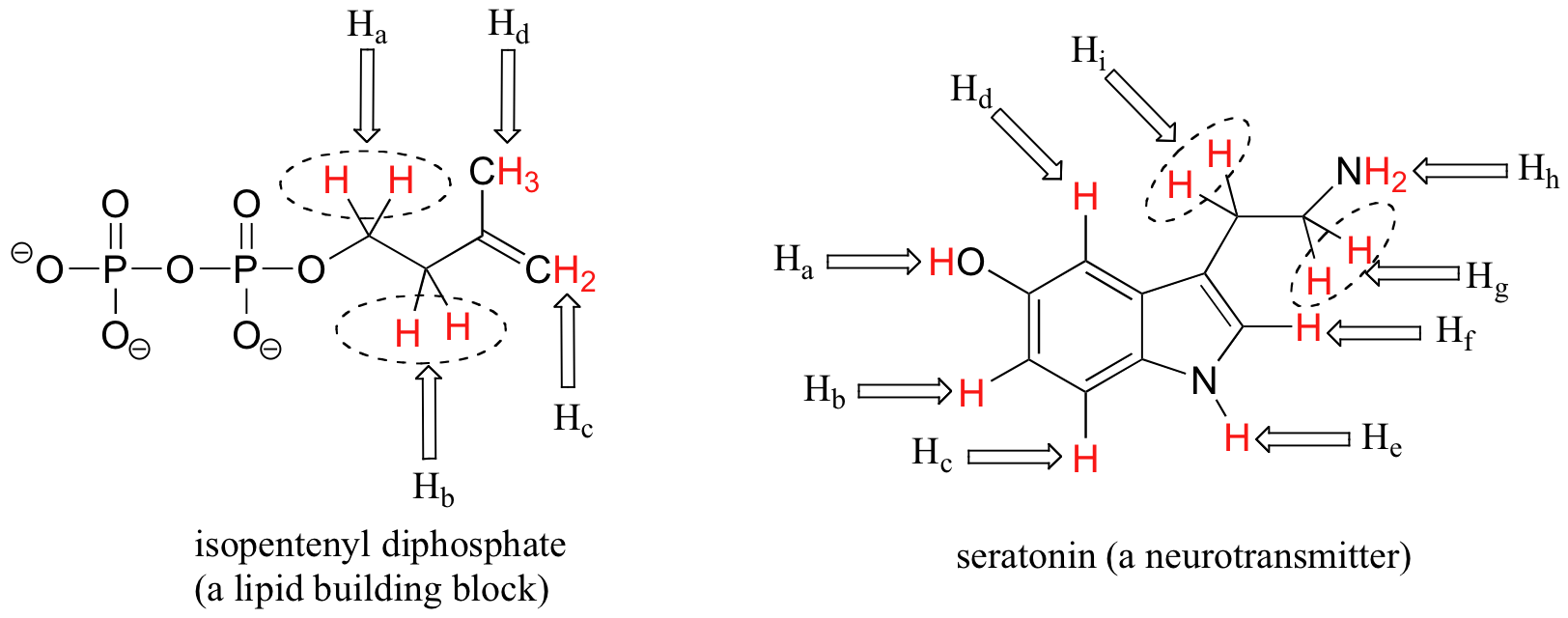
Cuando se toma en cuenta la estereoquímica, el tema de equivalencia vs no equivalencia en RMN comienza a complicarse un poco más. Debe ser bastante intuitivo que los hidrógenos en diferentes lados de estructuras de anillos asimétricos y dobles enlaces estén en diferentes entornos electrónicos, y por lo tanto no sean equivalentes y tengan diferentes frecuencias de resonancia. En las estructuras de alqueno y ciclohexeno a continuación, por ejemplo, H a es trans al sustituyente cloro, mientras que H b es cis a cloro.
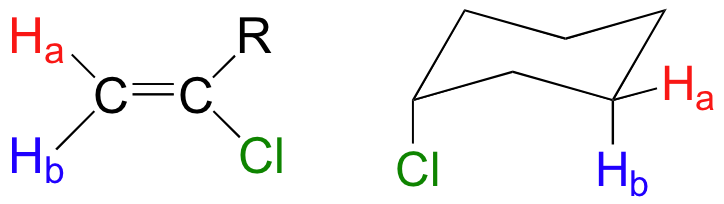
Lo que no es tan intuitivo es que los hidrógenos diastereotópicos (sección 3.10) sobre las moléculas quirales tampoco son equivalentes:
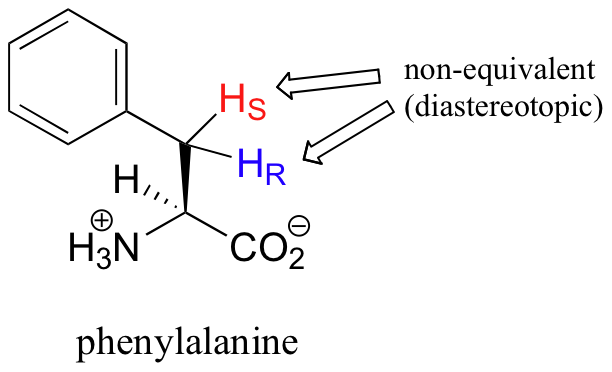
Sin embargo, los hidrógenos enantiotópicos y homotópicos son químicamente equivalentes.
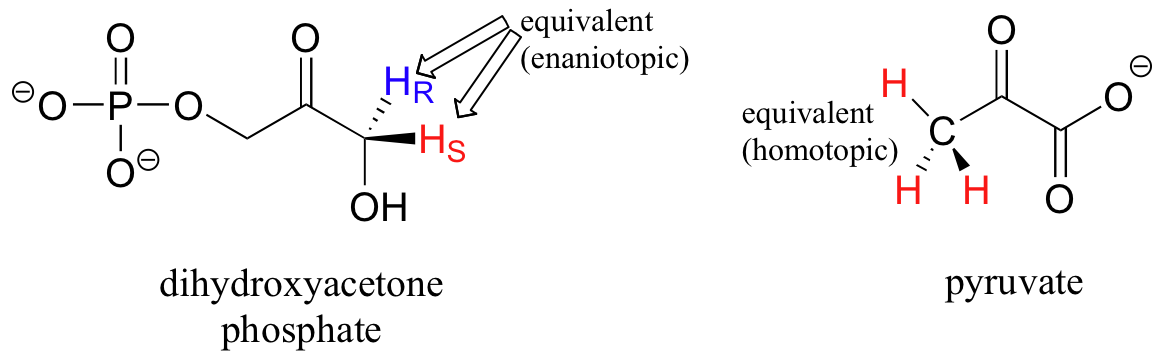
Ejercicio
6. Cuántos hidrógeno no equivalente hay en las siguientes moléculas; cuántas señales diferentes verás en un espectro de RMN H 1.
A. CH 3 CH 2 CH 2 Br
B. CH 3 OCH 2 C (CH 3) 3
C. Benceno etílico
D. 2-metil-1-hexeno
- Responder
-
6. A. 3; B. 3; C. 5; D. 7
Colaboradores y Atribuciones
Dr. Dietmar Kennepohl FCIC (Professor of Chemistry, Athabasca University)
Prof. Steven Farmer (Sonoma State University)
Organic Chemistry With a Biological Emphasis by Tim Soderberg (University of Minnesota, Morris)

