12.10: Espectroscopía de RMN 1³C
- Page ID
- 76616
Los fundamentos de la espectroscopía de 13 C-RMN
El momento magnético de un núcleo de 13 C es mucho más débil que el de un protón, lo que significa que las señales de RMN de 13 núcleos C son inherentemente mucho más débiles que las señales de protones. Esto, combinado con la baja abundancia natural de 13 C, significa que es mucho más difícil observar las señales de carbono: se requiere más muestra y, a menudo, los datos de cientos de escaneos deben promediarse para reducir la relación señal/ruido a niveles aceptables. A diferencia de las señales de 1H-RMN, el área bajo una señal de 13 C-RMN no puede ser utilizada para determinar el número de carbonos a los que corresponde. Esto se debe a que las señales para algunos tipos de carbonos son inherentemente más débiles que para otros tipos; los picos correspondientes a los carbonos de carbonilo, por ejemplo, son mucho más pequeños que los de los picos de metilo o metileno (CH 2). La integración de picos generalmente no es útil en la espectroscopía de 13 C-RMN, excepto cuando se investigan moléculas que han sido enriquecidas con isótopo 13 C (ver sección 5.6B).
Las frecuencias de resonancia de 13 núcleos C son menores que las de los protones en el mismo campo aplicado; en un instrumento Tesla de 7.05, los protones resuenan a aproximadamente 300 MHz, mientras que los carbonos resuenan a aproximadamente 75 MHz. Esto es afortunado, ya que nos permite mirar 13 señales C usando una 'ventana' completamente separada de frecuencias de radio. Al igual que en 1H-NMR, el estándar utilizado en 13 experimentos de RMN C para definir el punto de 0 ppm es el tetrametilsilano (TMS), aunque por supuesto en 13 C-NMR es la señal de los cuatro carbonos equivalentes en TMS la que sirve como estándar. Los desplazamientos químicos para núcleos de 13 C en moléculas orgánicas se extienden en un rango mucho más amplio que para los protones, hasta 200 ppm para 13 C en comparación con 12 ppm para protones (ver Tabla 3 para una lista de 13 desplazamientos químicos de RMN C típicos). Esto también es afortunado, porque significa que la señal de cada carbono en un compuesto casi siempre puede verse como un pico distinto, sin el solapamiento que a menudo afecta a 1 espectros de H-RMN. El desplazamiento químico de un núcleo de 13 C está influenciado esencialmente por los mismos factores que influyen en el desplazamiento químico de un protón: los enlaces a átomos electronegativos y los efectos de anisotropía diamagnética tienden a desplazar las señales campo abajo (mayor frecuencia de resonancia). Además, la hibridación sp 2 da como resultado un gran cambio de campo abajo. Las 13 señales de C-RMN para los carbonos carbonílicos son generalmente las más alejadas (170-220 ppm), debido tanto a la hibridación sp 2 como al doble enlace con el oxígeno.
Ejemplo\(\PageIndex{1}\)
¿Cuántos conjuntos de carbonos no equivalentes hay en cada una de las moléculas mostradas en el ejercicio 5.1?
Ejemplo\(\PageIndex{2}\)
¿Cuántos conjuntos de carbonos no equivalentes hay en:
- tolueno
- 2-pentanona
- para-xileno
- triclosán
Debido a la baja abundancia natural de 13 núcleos C, es muy poco probable que se encuentren dos 13 átomos de C cerca uno del otro en la misma molécula, y por lo tanto no vemos acoplamiento espín-espín entre carbonos vecinos en una RMN de 13 C espectro. Sin embargo, existe acoplamiento heteronuclear entre 13 carbonos C y los hidrógenos a los que están unidos. Las constantes de acoplamiento carbono-protón son muy grandes, del orden de 100 — 250 Hz. Para mayor claridad, los químicos generalmente utilizan una técnica llamada desacoplamiento de banda ancha, que esencialmente 'desactiva 'el acoplamiento C-H, dando como resultado un espectro en el que todas las señales de carbono son singletes. A continuación se muestra el espectro de 13 C-RMN de protones desacoplados del acetato de etilo, mostrando las cuatro señales esperadas, una para cada uno de los carbonos.
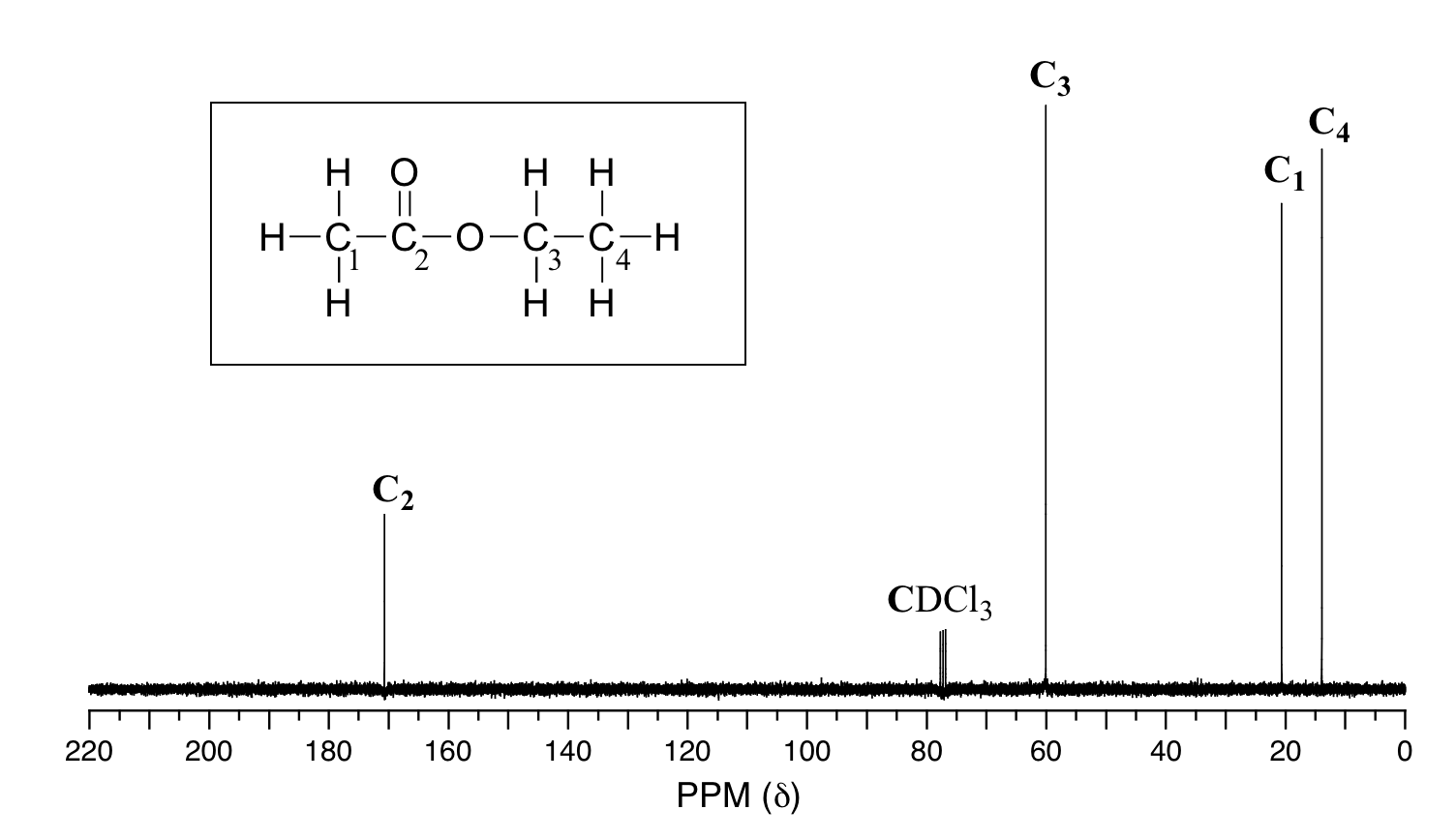
Si bien el desacoplamiento de banda ancha da como resultado un espectro mucho más simple, se pierde información útil sobre la presencia de protones vecinos. Sin embargo, otra técnica moderna de RMN llamada DEPT (Distortionless Enhancement by Polarization Transfer) nos permite determinar cuántos hidrógenos están unidos a cada carbono. Por ejemplo, un experimento DEPT nos dice que la señal a 171 ppm en el espectro del acetato de etilo es un carbono cuaternario (sin hidrógenos unidos, en este caso un carbono carbonilo), que la señal de 61 ppm es de un carbono de metileno (CH 2), y que las señales de 21 ppm y 14 ppm son ambas metilo (CH 3 ) carbonos. Los detalles del experimento DEPT están fuera del alcance de este texto, pero a menudo se proporcionará información del DEPT junto con datos espectrales de 13 C en ejemplos y problemas.
Colaboradores y Atribuciones
Prof. Steven Farmer (Sonoma State University)
Chris P Schaller, Ph.D., (College of Saint Benedict / Saint John's University)

