12.12: Espectroscopia de RMN 1³C y DEPT
- Page ID
- 76630
Mejora de las Distorsiones por Transferencia de Polarización (DEPT)
DEPT se utiliza para distinguir entre un grupo CH 3, un grupo CH 2 y un grupo CH. El pulso de protones se establece a 45°, 90° o 135° en los tres experimentos separados. Los diferentes pulsos dependen del número de protones unidos a un átomo de carbono. La Fig. 11. es un ejemplo sobre el espectro DEPT.
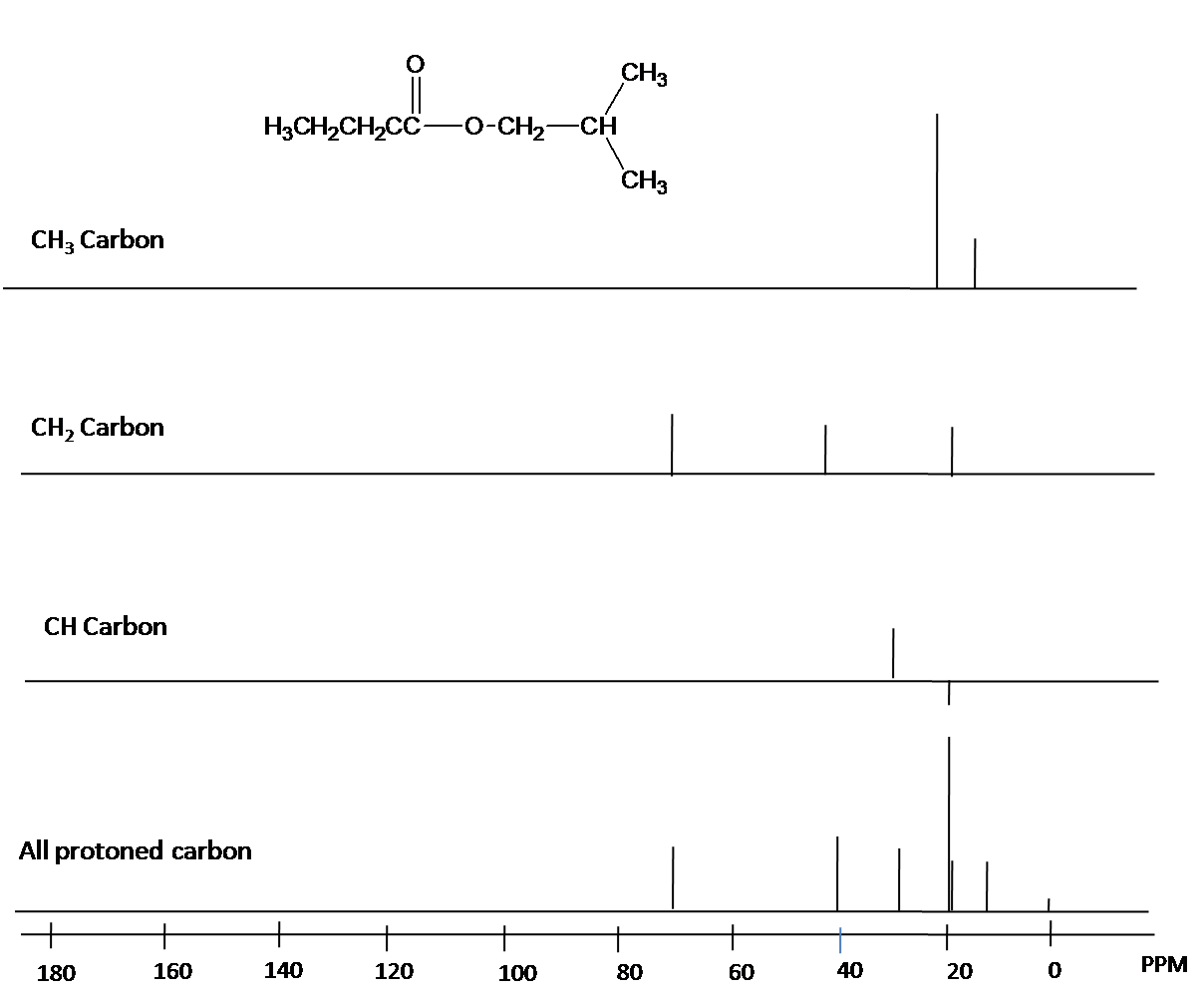
Fig. 11. Espectro DEPT de n-isobutlibutrato
Si bien el desacoplamiento de banda ancha resulta en un espectro mucho más simple, se pierde información útil sobre la presencia de protones vecinos. Sin embargo, otra técnica moderna de RMN llamada DEPT (Distortionless Enhancement by Polarization Transfer) nos permite determinar cuántos hidrógenos están unidos a cada carbono. Por ejemplo, un experimento DEPT nos dice que la señal a 171 ppm en el espectro del acetato de etilo es un carbono cuaternario (sin hidrógenos unidos, en este caso un carbono carbonilo), que la señal de 61 ppm es de un carbono de metileno (CH 2), y que las señales de 21 ppm y 14 ppm son ambas metilo (CH 3 ) carbonos. Los detalles del experimento DEPT están fuera del alcance de este texto, pero a menudo se proporcionará información del DEPT junto con datos espectrales de 13 C en ejemplos y problemas.
A continuación se presentan dos ejemplos más de 13 espectros de RMN C de moléculas orgánicas simples, junto con información del DEPT.
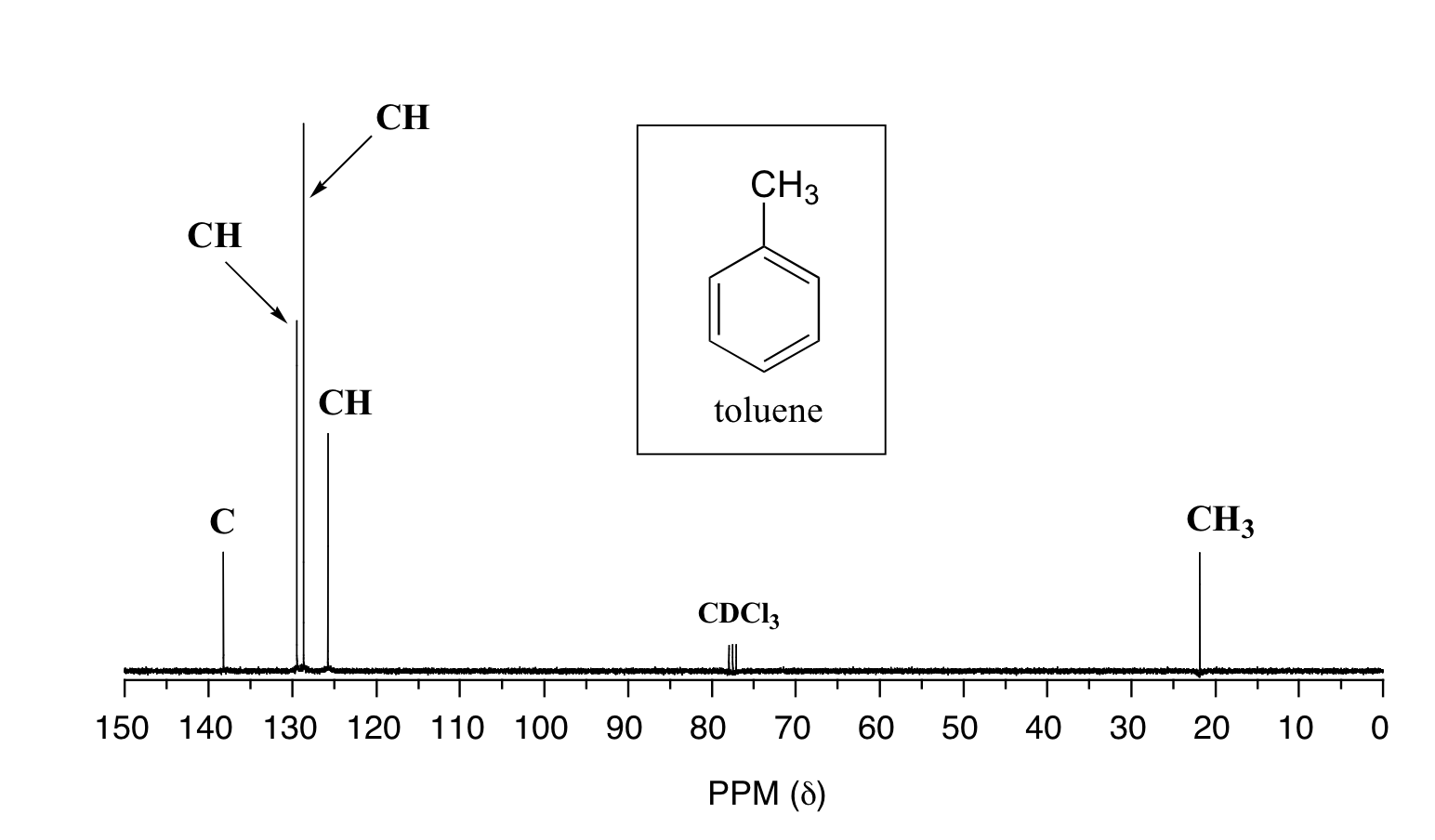
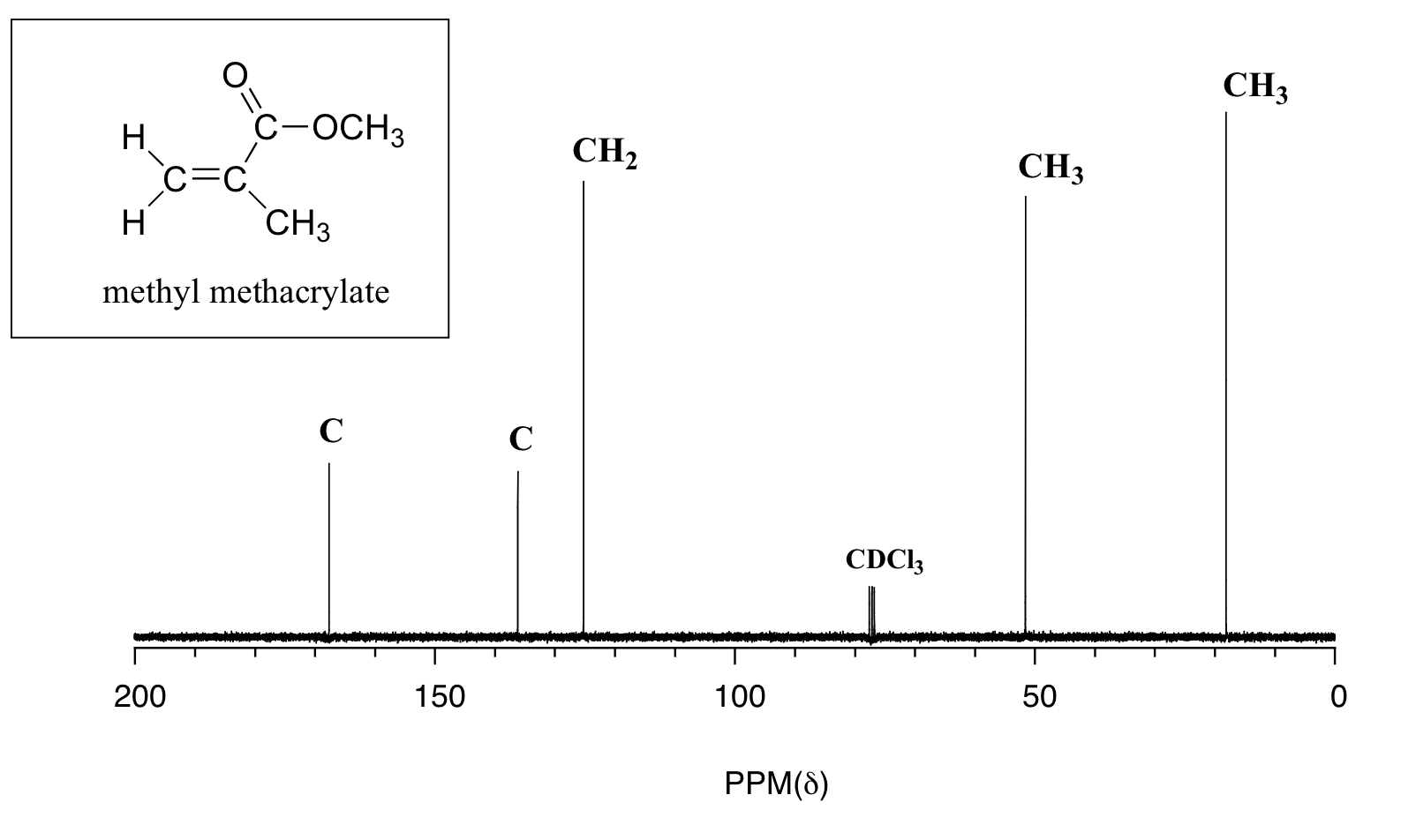
Ejemplo 13.5.2
Dar asignaciones de picos para el espectro de 13 C-RMN de metacrilato de metilo, mostrado anteriormente.
En el espectro de 13 C de una misma molécula, sin embargo, podemos distinguir fácilmente cada señal de carbono, y sabemos por estos datos que nuestra muestra tiene siete carbonos no equivalentes. (Observe también que, como esperaríamos, los desplazamientos químicos de los carbonos se hacen progresivamente más pequeños a medida que se alejan más del oxígeno deshielding).
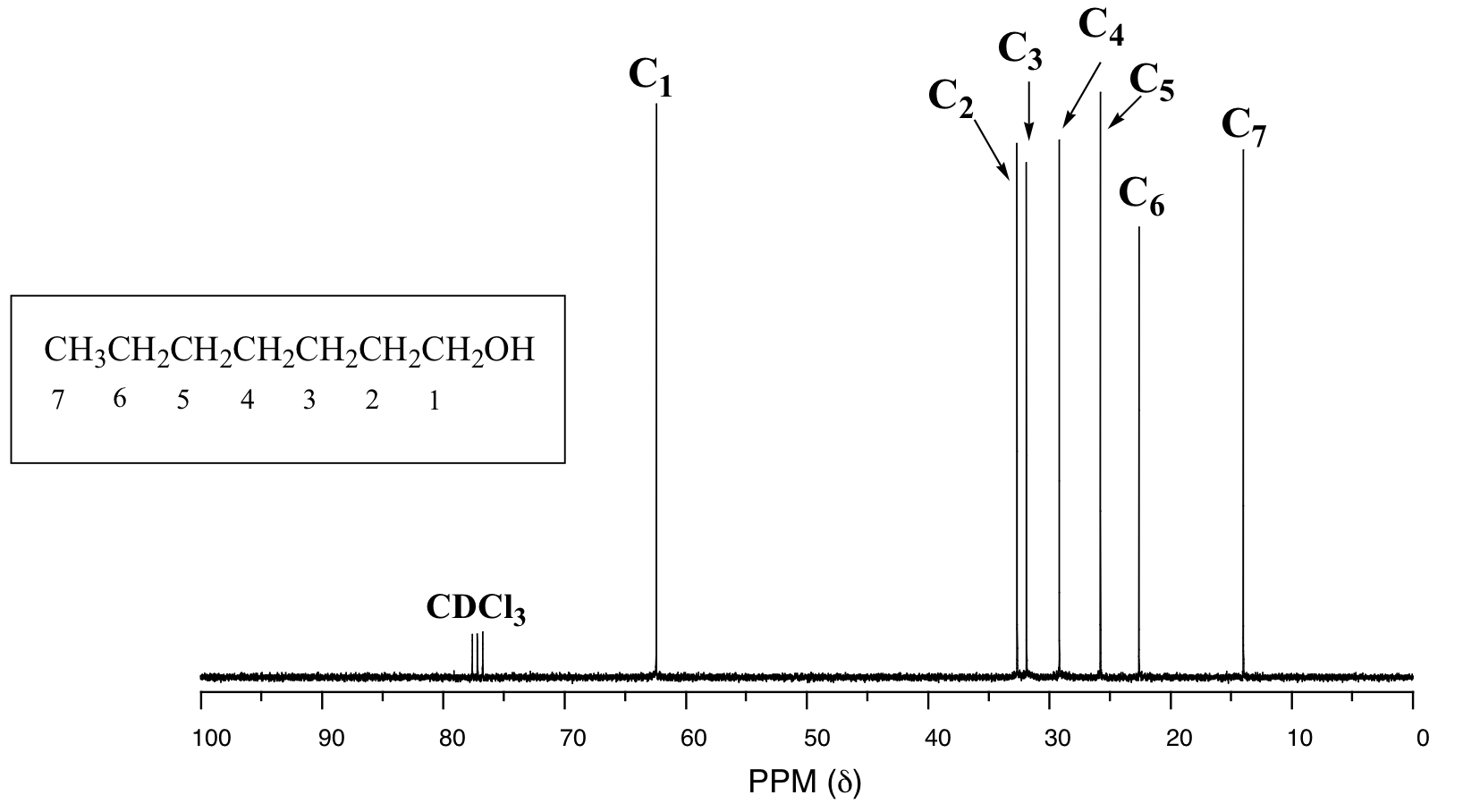
Esta propiedad de 13 C-NMR la hace muy útil en la elucidación de estructuras más grandes y complejas.
Ejemplo 13.5.3
13 Los datos de C-RMN (y DEPT) para algunas biomoléculas comunes se muestran a continuación (los datos son de la Biblioteca Aldrich de 1H y 13C NMR). Hacer coincidir los datos de RMN con la estructura correcta y realizar asignaciones completas de picos.
- espectro a: 168.10 ppm (C), 159.91 ppm (C), 144.05 ppm (CH), 95.79 ppm (CH)
- espectro b: 207.85 ppm (C), 172.69 ppm (C), 29.29 ppm (CH 3)
- espectro c: 178.54 ppm (C), 53.25 ppm (CH), 18.95 ppm (CH 3)
- espectro d: 183.81 ppm (C), 182. 63 ppm (C), 73.06 ppm (CH), 45.35 ppm (CH 2)
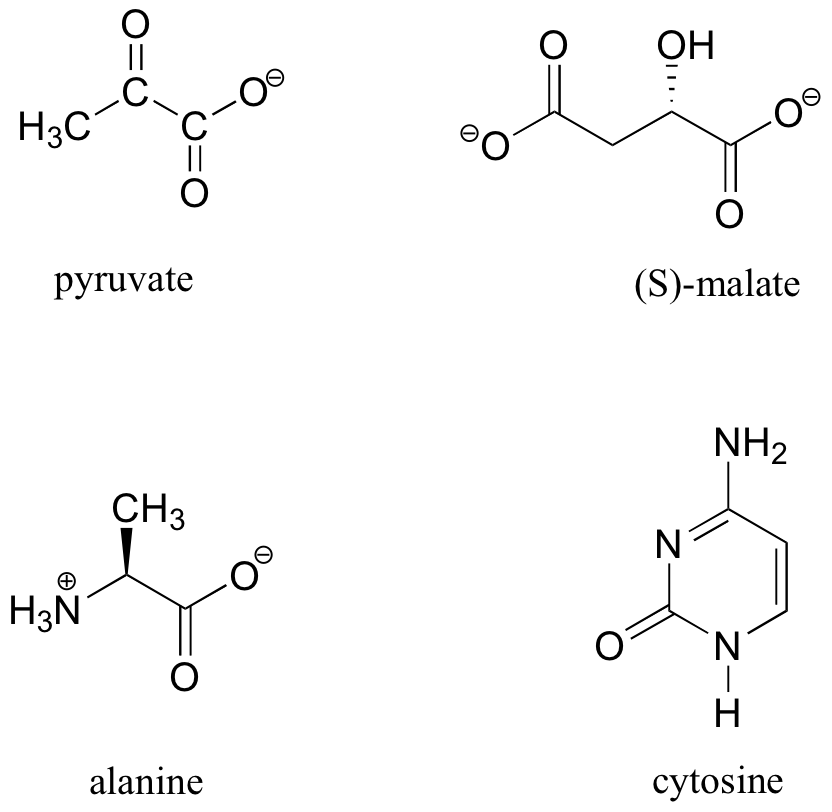
Solución
13 Cambios químicos de RMN C
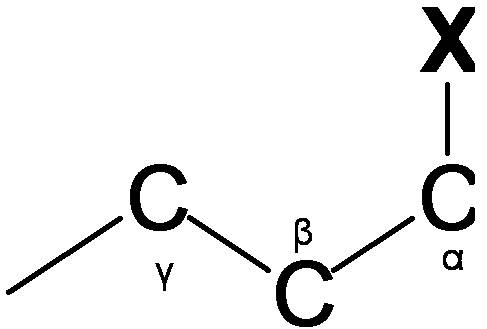
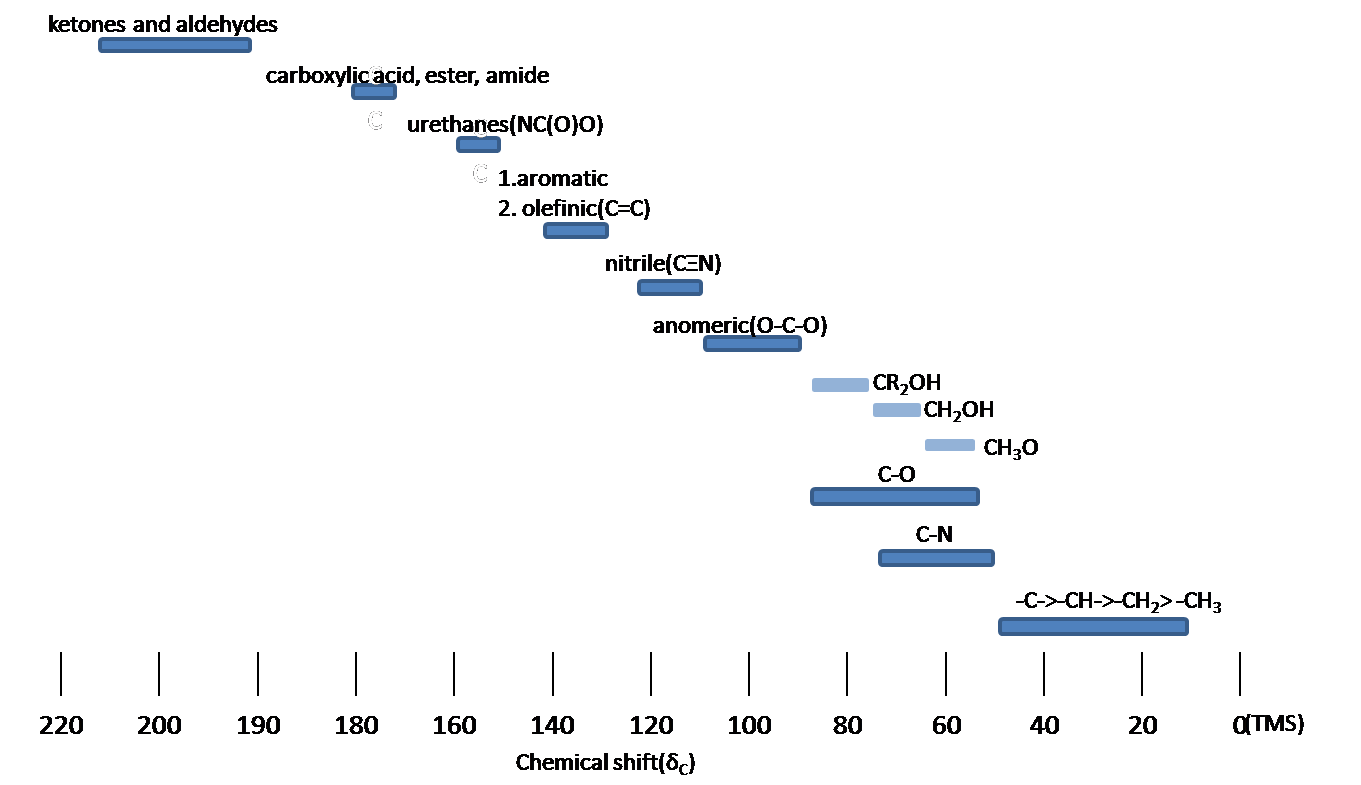
La RMN de carbono se utiliza para determinar grupos funcionales usando valores de desplazamiento característicos. El desplazamiento químico de 13 C se ve afectado por el efecto electronegativo y el efecto estérico. Si un átomos de H en un alcano se reemplaza por sustituyente X, átomos electronegativos (O, N, halógeno),? -carbono y? -cambio de carbono a campo abajo (izquierda; aumento en ppm) mientras? -el carbono se desplaza al campo superior. El efecto estérico se observa en el sistema acíclico y clíclico, lo que conduce a desplazamientos químicos descendentes. La Figura 9 muestra las regiones típicas de desplazamiento químico de 13 C de la clase química principal.
División Spin-Spin
Comparando la RMN 1H, hay una gran diferencia en la RMN de 13 C. La división de espín-espín de 13 C- 13 rara vez sale entre carbonos adyacentes porque 13 C es naturalmente menor abundante (1.1%)
- 13 C- 1 H Acoplamiento de espín: 13 C- 1 H El acoplamiento de espín proporciona información útil sobre el número de protones unidos a un átomo de carbono. En el caso de un acoplamiento de enlace (1 J CH), -CH, -CH 2 y CH 3 tienen respectivamente doblete, triplete, cuartetos para las resonancias de 13 C en el espectro. Sin embargo, el acoplamiento por giro de 13 C- 1 H tiene una desventaja para la interpretación del espectro de 13 C. 13 C- 1 H El acoplamiento por espín es difícil de analizar y revelar estructura debido a un bosque de picos superpuestos que resultan de una abundancia del 100% de 1 H.
- Desacoplamiento: El desacoplamiento es el proceso de eliminar la interacción de acoplamiento 13 C- 1H para simplificar un espectro e identificar qué par de núcleos están involucrados en el acoplamiento J. El espectro de desacoplamiento 13 C muestra solo un pico (singlete) por cada carbono único en la molécula (Fig. 10.). El desacoplamiento se realiza irradiando a la frecuencia de un protón con RF continua de baja potencia.
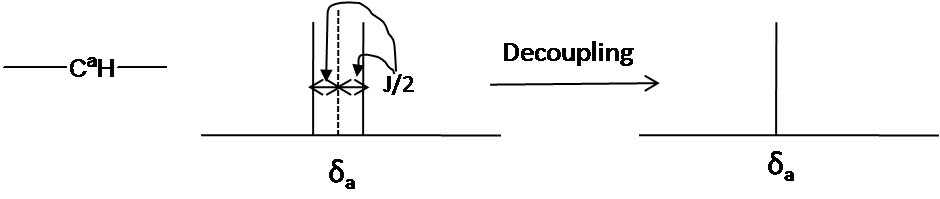
Fig. 10. Desacoplamiento en la RMN de 13 C
Colaboradores
Prof. Steven Farmer (Sonoma State University)
Organic Chemistry With a Biological Emphasis by Tim Soderberg (University of Minnesota, Morris)
Chris P Schaller, Ph.D., (College of Saint Benedict / Saint John's University)

