14.1: Reacciones de Alcoholes con Ácidos Hidrohalogenados
- Page ID
- 76333
Conversión de alcoholes en haluros de alquilo
Cuando los alcoholes reaccionan con un haluro de hidrógeno, tiene lugar una sustitución produciendo un haluro de alquilo y agua:
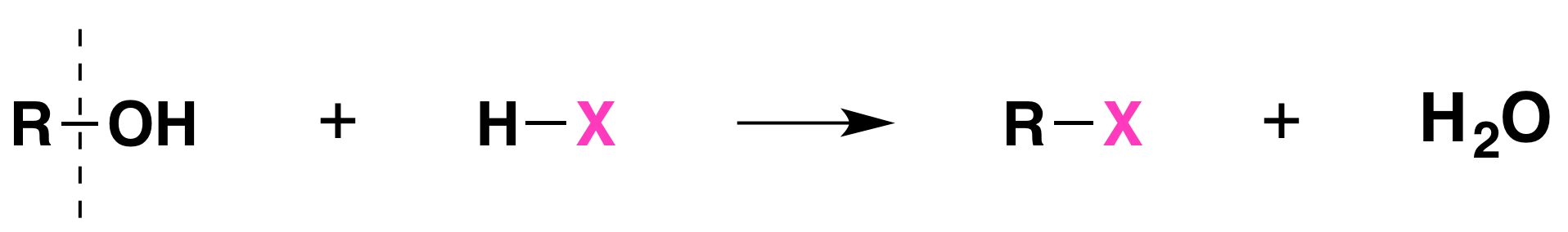
- El orden de reactividad de los alcoholes es 3° > 2° > 1° metilo.
- El orden de reactividad de los haluros de hidrógeno es HI > HBr > HCl (el HF es generalmente no reactivo).
La reacción es catalizada por ácido. Los alcoholes reaccionan con los haluros de hidrógeno fuertemente ácidos HCl, HBr e HI, pero no reaccionan con NaCl, NaBr o NaI no ácidos. Los alcoholes primarios y secundarios se pueden convertir en cloruros y bromuros de alquilo permitiéndoles reaccionar con una mezcla de haluro de sodio y ácido sulfúrico:
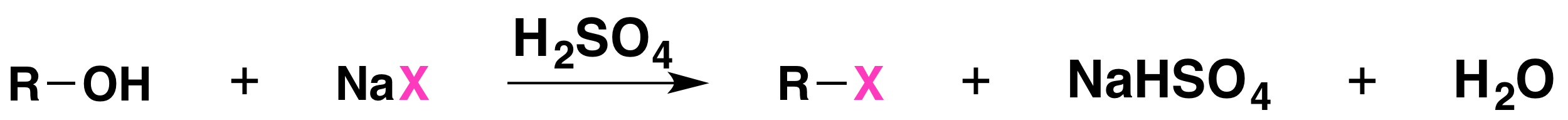
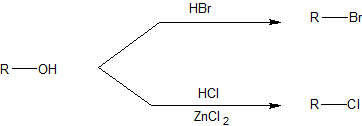
Debido a que Cl- es un nucleófilo más débil que Br-, la reacción con HCl requiere un catalizador como ZnCl2 como se muestra a continuación.
Mecanismos de las Reacciones de Alcoholes con HX
Los alcoholes secundarios, terciarios, alílicos y bencílicos parecen reaccionar por un mecanismo que implica la formación de un carbocatión, en una \(S_N1\)reacción con el alcohol protonado actuando como sustrato.
El\(S_N1\) mecanismo se ilustra por la reacción alcohol terc-butílico y ácido clorhídrico acuoso (\(H_3O^+\),\(Cl^-\)). Los dos primeros pasos en este mecanismo de\(S_n1\) sustitución son la protonación del alcohol para formar un ion oxonio. Aunque el ion oxonio se forma por protonación del alcohol, también puede verse como un complejo ácido-base de Lewis entre el catión (\(R^+\)) y\(H_2O\). La protonación del alcohol convierte a un grupo pobre de salida (OH-) en un buen grupo de salida agua, H 2 O, lo que hace que la etapa de disociación del\(S_N1\) mecanismo sea más favorable.
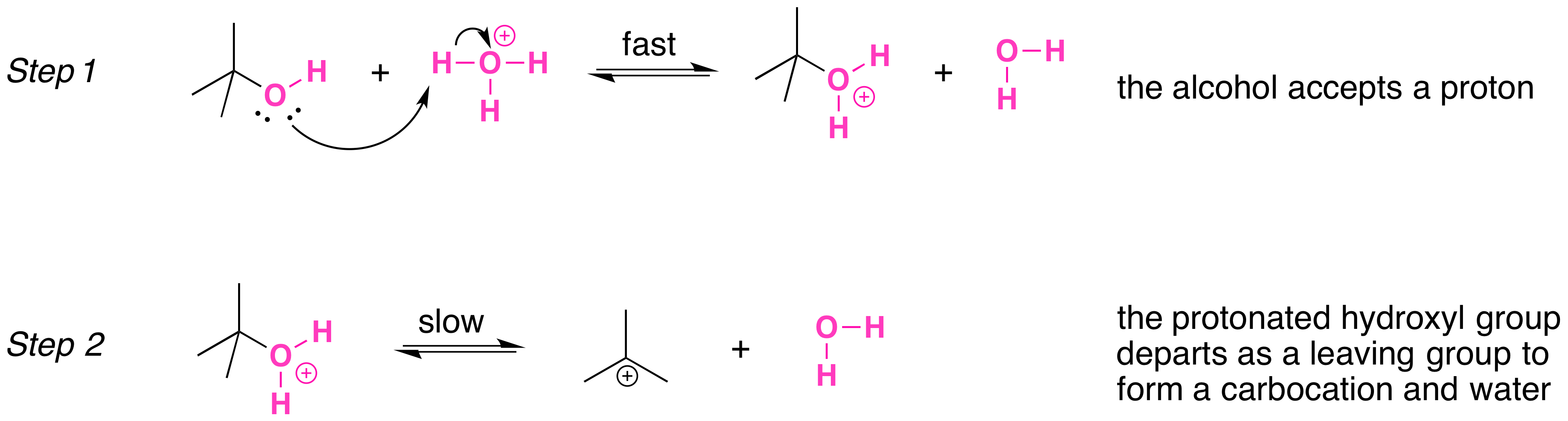
En la etapa 3, el carbocatión reacciona con un nucleófilo (un ion haluro) para completar la sustitución.

Cuando convertimos un alcohol en un haluro de alquilo, llevamos a cabo la reacción en presencia de ácido y en presencia de iones haluro, y no a temperatura elevada. Los iones haluro son buenos nucleófilos (son nucleófilos mucho más fuertes que el agua), y dado que los iones haluro están presentes en alta concentración, la mayoría de los carbocationes reaccionan con un par de electrones de un ion haluro para formar una especie más estable, el producto haluro de alquilo. El resultado general es una reacción de S N 1.
No todas las conversiones catalizadas por ácido de alcoholes a haluros de alquilo proceden a través de la formación de carbocationes. Los alcoholes primarios y el metanol reaccionan para formar haluros de alquilo en condiciones ácidas mediante un mecanismo S N 2.
En estas reacciones la función del ácido es producir un alcohol protonado. El ion haluro desplaza entonces una molécula de agua (un buen grupo lábil) del carbono; esto produce un haluro de alquilo:
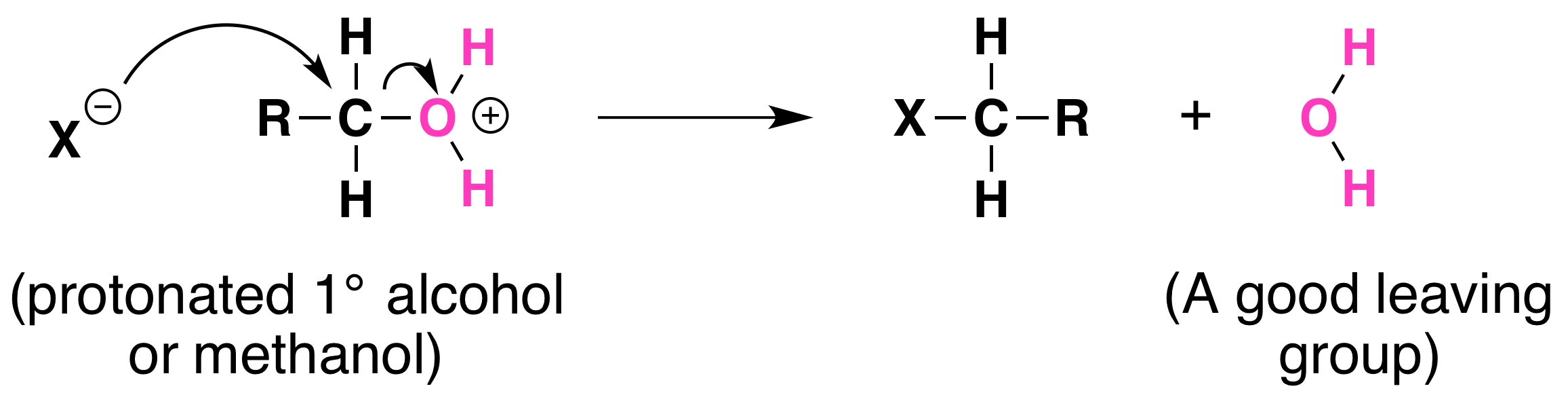
Nuevamente, se requiere ácido. Aunque los iones haluro (particularmente los iones yoduro y bromuro) son nucleófilos fuertes, no son lo suficientemente fuertes como para llevar a cabo reacciones de sustitución con los propios alcoholes. El desplazamiento directo del grupo hidroxilo no ocurre porque el grupo lábil tendría que ser un ion hidróxido fuertemente básico:

Ahora podemos ver por qué las reacciones de los alcoholes con haluros de hidrógeno son promovidas por ácidos.
Los reordenamientos de carbocationes son extremadamente comunes en la química orgánica. Las reacciones se definen como el movimiento de un carbocatión de un estado inestable a un estado más estable mediante el uso de diversos “cambios” reorganizacionales estructurales dentro de la molécula. Una vez que el carbocatión se ha desplazado a un carbono diferente, podemos decir que existe un isómero estructural de la molécula inicial. Sin embargo, este fenómeno no es tan sencillo como parece.
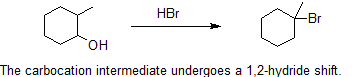
Los métodos más comunes para convertir los alcoholes 1º y 2º-en los correspondientes cloro y bromo alcanos (es decir, reemplazo del grupo hidroxilo) son los tratamientos con cloruro de tionilo y tribromuro de fósforo, respectivamente. Estos reactivos son generalmente preferidos sobre el uso de HX concentrado debido a la fuerte acidez de estos ácidos hidrohalogenados y los reordenamientos de carbocationes asociados con su uso. Las reacciones del alcohol con cloruro de tionilo o tribromuro de fósforo se discuten en la siguiente sección.
Ejercicios
1. Predecir el producto de cada reacción a continuación.
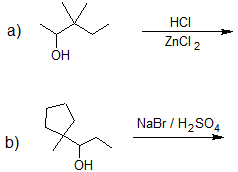
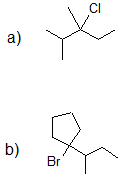
- Contestar
-
1.
Colaboradores y Atribuciones
Dr. Dietmar Kennepohl FCIC (Professor of Chemistry, Athabasca University)
Prof. Steven Farmer (Sonoma State University)
William Reusch, Professor Emeritus (Michigan State U.), Virtual Textbook of Organic Chemistry

