14.2: Reacciones con haluros de fósforo y cloruro de tionilo
- Page ID
- 76347
Contención de carbocationes
Los químicos orgánicos sintéticos utilizan tribromuro de fósforo y cloruro de tionilo para convertir un alcohol en un mejor grupo de salida sin reordenamiento de carbocationes.
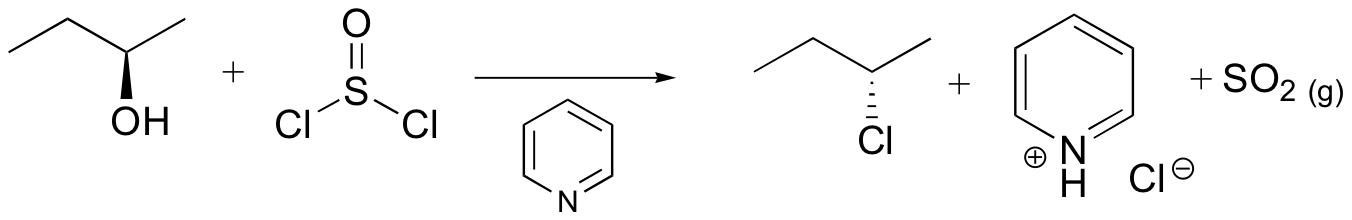
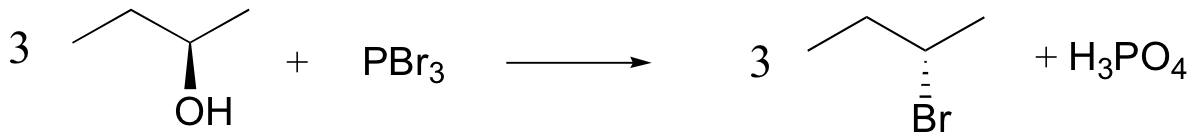
A pesar de su utilidad general, el tribromuro de fósforo y el cloruro de tionilo presentan deficiencias. Los alcoholes 1º y 2ºobstaculizados reaccionan lentamente con los primeros, y pueden formar productos de reordenamiento, como se señala en la siguiente ecuación.
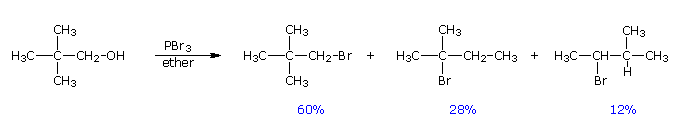
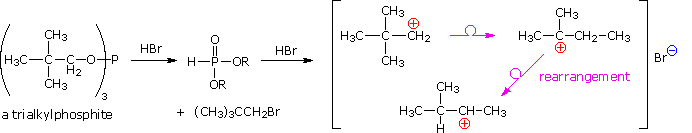
A continuación, se muestra un mecanismo abreviado para la reacción. El éster de fosfito de trialquilo formado inicialmente puede aislarse si el subproducto de HBr se elimina por base. En presencia de HBr tienen lugar una serie de reacciones ácido-base y S N 2, junto con la formación transitoria de intermedios de carbocationes. El reordenamiento (flechas rosadas) de los carbocationes conduce a productos isoméricos.
Se ha observado que la reacción del cloruro de tionilo con 2º-alcoholes quirales procede con inversión o retención. En presencia de una base como la piridina, el éster de clorosulfito intermedio reacciona para formar una sal de “piridinio”, la cual experimenta una reacción de S N 2 relativamente limpia al cloruro invertido. En éter y disolventes similares el clorosfito reacciona con retención de configuración, presumiblemente por medio de un par iónico estrecho o íntimo. Esta se clasifica como una reacción de S N i (sustitución nucleofílica interna). El compañero de carbocatión en el par iónico también puede reorganizarse. Estas reacciones se ilustran mediante las siguientes ecuaciones. Se ha sugerido una explicación alternativa para la retención de la configuración, que implica un desplazamiento inicial de la molécula solvente del grupo clorosulfito (como SO 2 y anión cloruro), seguido del desplazamiento de iones cloruro del grupo solvente. En este caso, dos inversiones conducen a la retención.

