14.10: Reacciones de los Alcóxidos
- Page ID
- 76334
Introducción
El átomo de hidrógeno de un grupo hidroxilo es ionizable y puede reemplazarse por otros sustituyentes como se ilustra en las reacciones siguientes. La primera reacción muestra alcoholes simples con sodio (e hidruro de sodio). La segunda reacción muestra el intercambio isotópico que se produce al mezclar un alcohol con óxido de deuterio (agua pesada). Este intercambio, que es catalizado por ácido o base, es rápido en condiciones normales debido a que es difícil evitar trazas de estos catalizadores en la mayoría de los sistemas experimentales.
2 R—O—H + 2 Na 2 R—O (—) Na (+) + H 2 2 R—O (—) Na (+) + H 2 |
R—O— H + D 2 O R—O— D + D —O— H R—O— D + D —O— H |
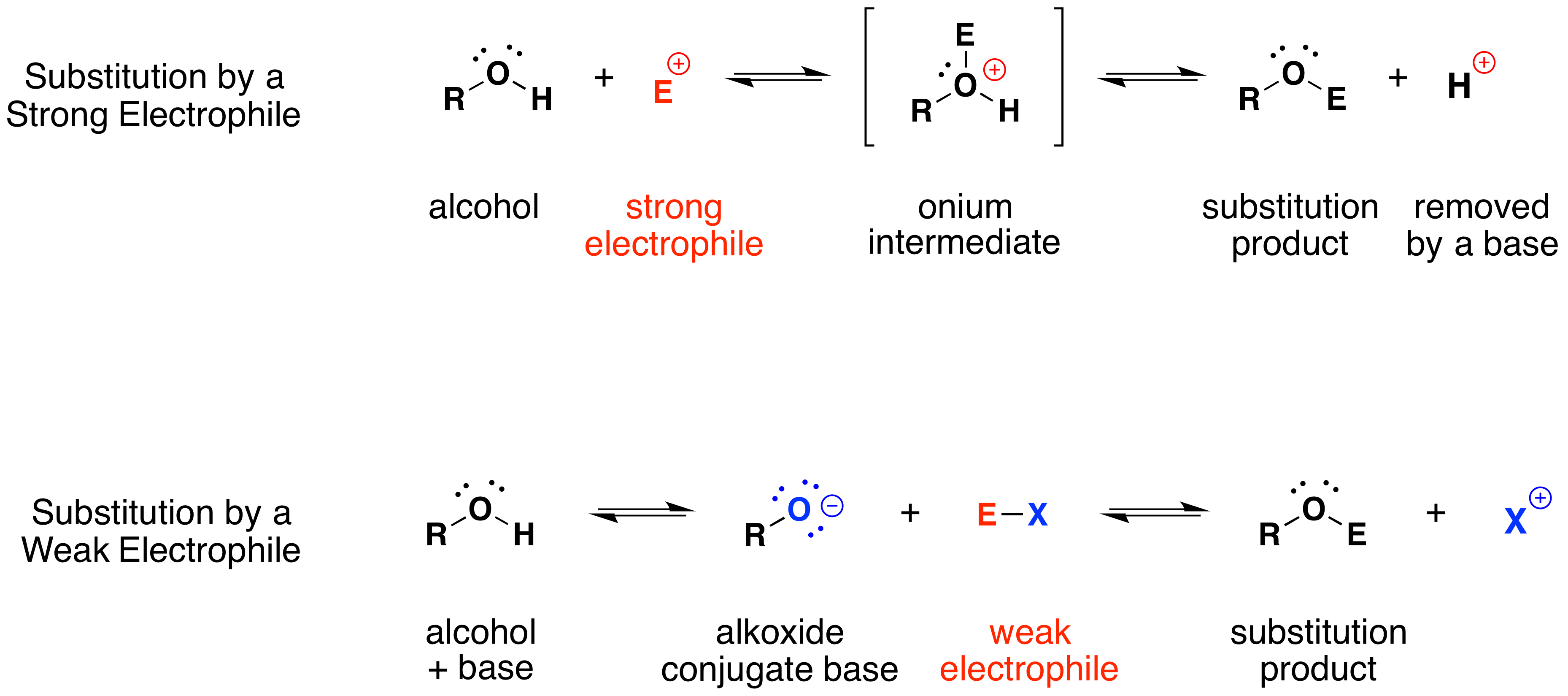
El mecanismo por el cual proceden estas reacciones de sustitución es sencillo. El átomo de oxígeno de un alcohol es nucleofílico; por lo tanto, es propenso a reaccionar con electrófilos. El intermedio “onio” resultante pierde entonces un protón a una base, formando el producto de sustitución. Si no está presente un electrófilo fuerte, entonces la nucleofilia del oxígeno puede mejorarse mediante la conversión a su base conjugada (un alcóxido). Este poderoso nucleófilo reacciona entonces con electrófilos débiles. Estas dos variaciones del mecanismo de sustitución se ilustran en el siguiente diagrama.
Williamson Ether Síntesis
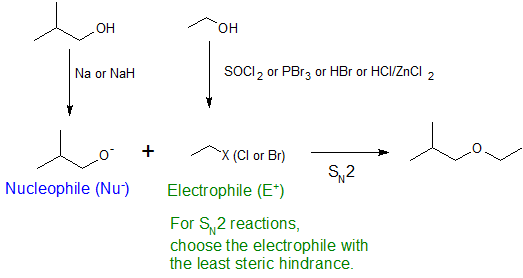
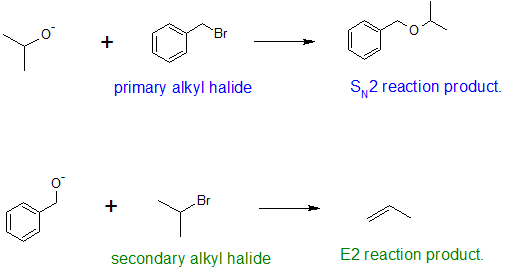
La sustitución alquílica del grupo hidroxilo crea éteres. Esta reacción proporciona ejemplos tanto de sustitución electrofílica fuerte (primera ecuación a continuación) como de sustitución electrófila débil (segunda ecuación). Esta última reacción de S N 2 se conoce como la síntesis de éter de Williamson y generalmente solo se usa con reactivos de haluro de 1º alquilo porque la base alcóxido fuerte conduce a E2 eliminación con haluros de alquilo de 2º y 3º.
Ejercicio
16. Muestre cómo usaría la síntesis de Williamson Ether para hacer 1-etoxi-2-metilpropano a partir de alcohol isobutílico y etanol.
- Contestar
-
16.