16.10: Interpretación de los espectros ultravioleta - El efecto de la conjugación
- Page ID
- 76046
Espectroscopia UV y Transiciones de Electrones Pi entre HOMO y LUMO
El máximo de absorción ultravioleta de una molécula conjugada depende del grado de conjugación. A medida que aumenta la conjugación, la energía Orbital Molecular disminuye de manera que las transiciones de electrones pi ocurren en las regiones UV y visibles del espectro electromagnético. Las moléculas o partes de moléculas que absorben la luz fuertemente en la región UV-Vis se denominan cromóforos.
Cuando una molécula de doble enlace como el eteno (nombre común etileno) absorbe la luz, se somete a una transición π - π *. Debido a que los huecos de energía π - π * son más estrechos que los huecos σ - σ *, el eteno absorbe la luz a 165 nm, una longitud de onda más larga que el hidrógeno molecular.

Las transiciones electrónicas tanto del hidrógeno molecular como del eteno son demasiado energéticas para ser registradas con precisión por espectrofotómetros UV estándar, que generalmente tienen un rango de 220 — 700 nm. Donde la espectroscopia UV-Vis se vuelve útil para la mayoría de los químicos orgánicos y biológicos es en el estudio de moléculas con sistemas pi conjugados. En estos grupos, la brecha de energía para las transiciones π - π * es menor que para los dobles enlaces aislados, y así la longitud de onda absorbida es más larga.
Revisemos la imagen MO para 1,3-butadieno, el sistema conjugado más simple. Recordemos que podemos dibujar un diagrama que muestre los cuatro pi MO que resultan de combinar los cuatro orbitales atómicos de 2p z. Los dos orbitales inferiores están pegando, mientras que los dos superiores son antiadhesivos.
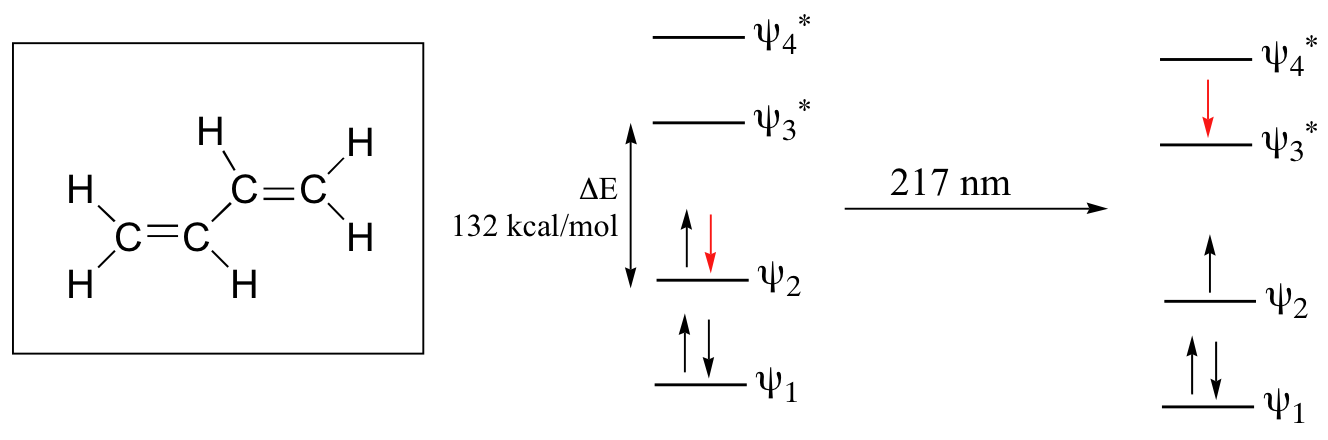
Comparando esta imagen MO con la del eteno, nuestro ejemplo aislado de enlace pi, vemos que la brecha de energía HOMO-LUMO es de hecho más pequeña para el sistema conjugado. El 1,3-butadieno absorbe la luz UV con una longitud de onda de 217 nm.
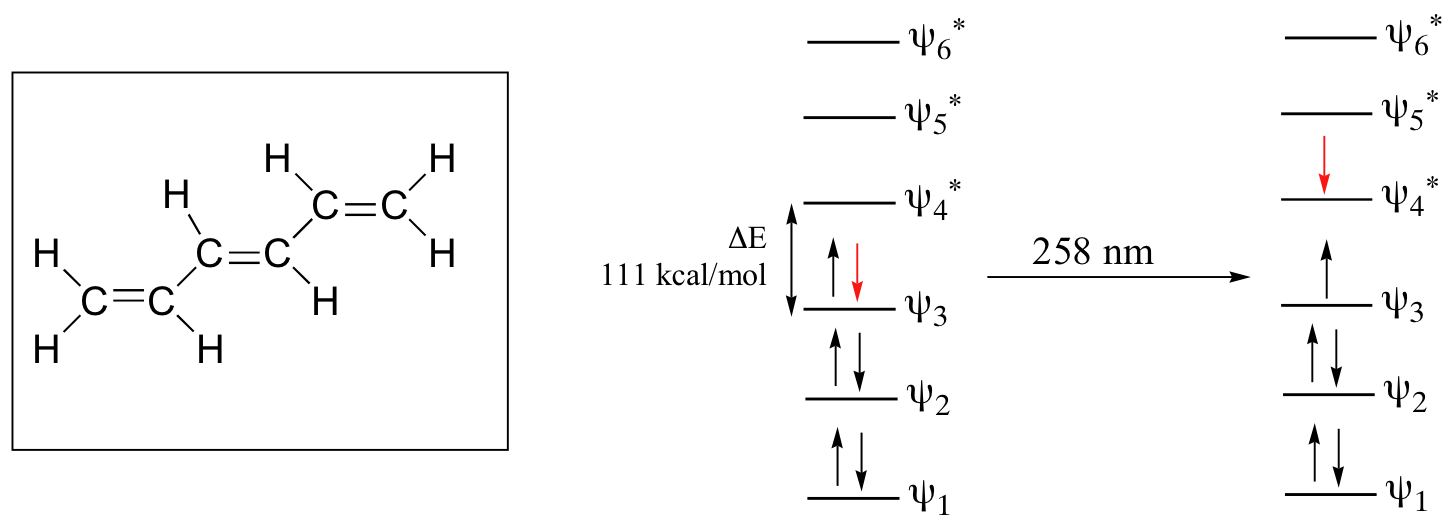
A medida que los sistemas pi conjugados se hacen más grandes, la brecha de energía para una transición π - π * se vuelve cada vez más estrecha, y la longitud de onda de la luz absorbida correspondientemente se hace La absorbancia debida a la transición π - π * en 1,3,5-hexatrieno, por ejemplo, ocurre a 258 nm, correspondiente a una Δ E de 111 kcal/mol.
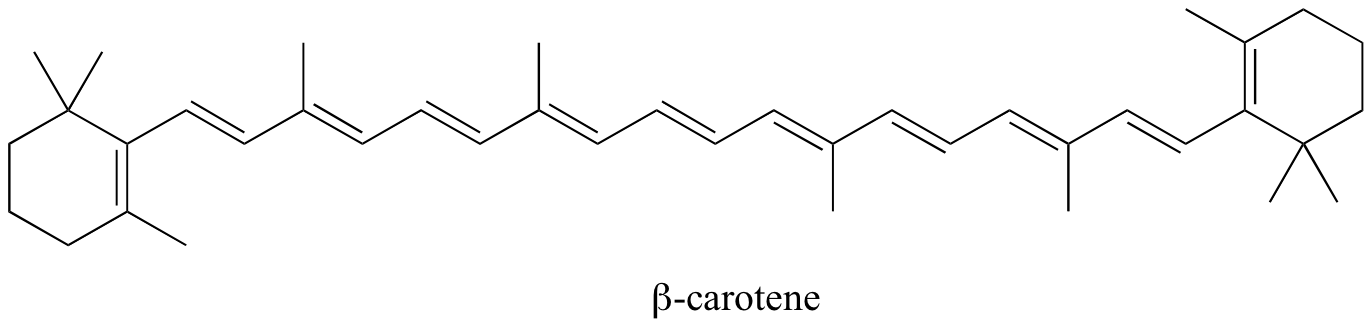
En las moléculas con sistemas pi extendidos, la brecha de energía HOMO-LUMO se vuelve tan pequeña que la absorción ocurre en la región visible y no en la región UV del espectro electromagnético. El betacaroteno, con su sistema de 11 dobles enlaces conjugados, absorbe la luz con longitudes de onda en la región azul del espectro visible al tiempo que permite transmitir otras longitudes de onda visibles —principalmente las de la región rojo-amarilla—. Es por ello que las zanahorias son de color naranja.
El sistema pi conjugado en 4-metil-3-penten-2-ona da lugar a una fuerte absorbancia UV a 236 nm debido a una transición π - π *. Sin embargo, esta molécula también absorbe a 314 nm. Esta segunda absorbancia se debe a la transición de un electrón sin enlace (par solitario) en el oxígeno hasta un MO antienlace π *:
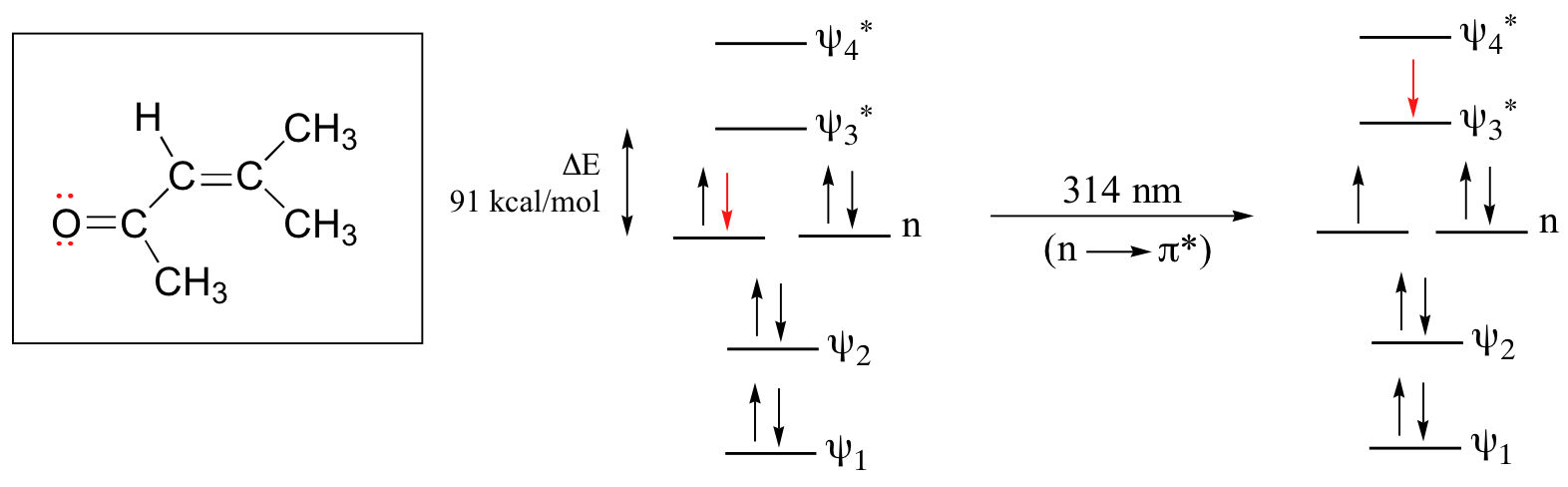
Esto se conoce como una transición n - π *. Los MO no enlazantes (n) son más altos en energía que los orbitales p de unión más altos, por lo que la brecha de energía para una transición n - π * es menor que la de una transición π - π *, y así el pico n - π * está a una longitud de onda más larga. En general, las transiciones n - π * son más débiles (menos luz absorbida) que las debidas a las transiciones π - π *.
Mirando los espectros UV-Vis 
Hemos estado hablando en términos generales sobre cómo las moléculas absorben la luz UV y la luz visible; ahora veamos algunos ejemplos reales de datos de un espectrofotómetro de absorbancia UV-Vis. La configuración básica es la misma que para la espectroscopia IR: la radiación con un rango de longitudes de onda se dirige a través de una muestra de interés, y un detector registra qué longitudes de onda fueron absorbidas y en qué medida ocurrió la absorción. A continuación se muestra el espectro de absorbancia de una importante molécula biológica llamada nicotinamida adenina dinucleótido, abreviado NAD + (aprenderemos lo que hace en la sección 16.4) Este compuesto absorbe luz en el rango UV debido a la presencia de sistemas de unión pi conjugados.
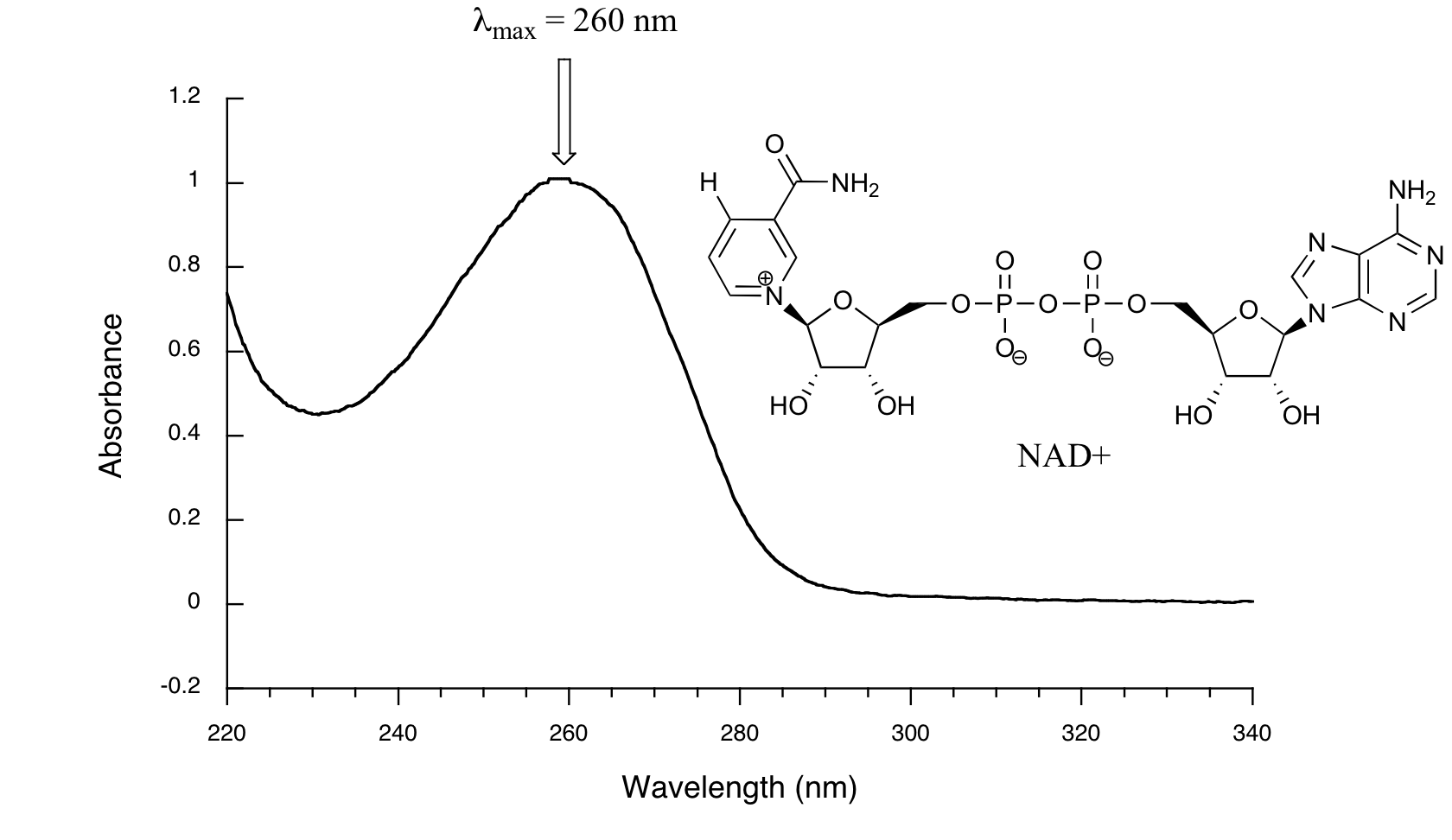
Notarás que este espectro UV es mucho más sencillo que los espectros IR que vimos antes: este solo tiene un pico, aunque muchas moléculas tienen más de uno. Observe también que la convención en espectroscopía UV-Vis es mostrar la línea base en la parte inferior de la gráfica con los picos apuntando hacia arriba. Los valores de longitud de onda en el eje x generalmente se miden en nanómetros (nm) en lugar de en cm -1 como es la convención en espectroscopía IR.
Los picos en los espectros UV tienden a ser bastante amplios, a menudo abarcando más de 20 nm a la altura media máxima. Por lo general, hay dos cosas que buscamos y grabamos a partir de un espectro UV-Vis.. El primero es λ max, que es la longitud de onda a la máxima absorbancia de luz. Como puede ver, el NAD + tiene λ max, = 260 nm. También queremos registrar cuánta luz se absorbe a λ máx. Aquí utilizamos un número sin unidad llamado absorbancia, abreviado 'A'. Esta contiene la misma información que el número de 'porcentaje de transmitancia' utilizado en la espectroscopia IR, solo expresado en términos ligeramente diferentes. Para calcular la absorbancia a una longitud de onda dada, la computadora en el espectrofotómetro simplemente toma la intensidad de la luz a esa longitud de onda antes de que pase a través de la muestra (I 0), divide este valor por la intensidad de la misma longitud de onda después de que pase a través del muestra (I), luego toma el log 10 de ese número:
A = log I 0 /I
Se puede ver que el valor de absorbancia a 260 nm (A 260) es de aproximadamente 1.0 en este espectro.
Aquí está el espectro de absorbancia del colorante alimentario común Rojo #3:

Aquí, vemos que el sistema extendido de enlaces pi conjugados hace que la molécula absorba luz en el rango visible. Debido a que el λ max de 524 nm cae dentro de la región verde del espectro, el compuesto aparece rojo a nuestros ojos.
Ahora, echa un vistazo al espectro de otro colorante alimentario, el Azul #1:
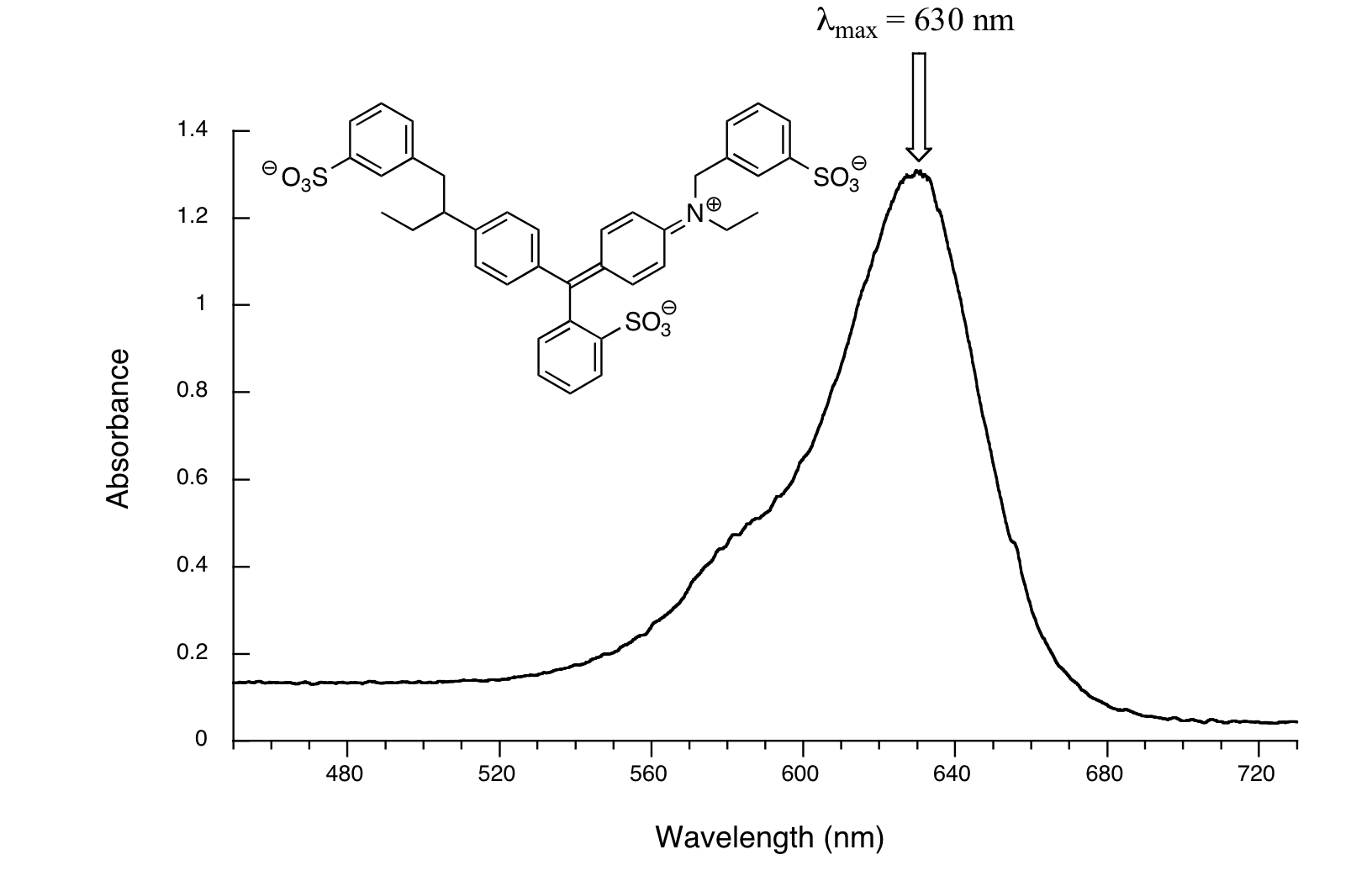
Aquí, la absorbancia máxima está a 630 nm, en el rango naranja del espectro visible, y el compuesto aparece azul.

