18.11: Reacciones de NAS - el Mecanismo de Eliminación-Adición (Benzino)
- Page ID
- 76058
Mecanismo de Eliminación-Adición de Sustitución Aromático Nucleofílica a través de Benzino (Arinos)
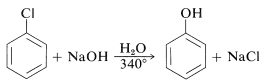
Las reactividades de los haluros de arilo, tales como los halobencenos, son extremadamente bajas hacia reactivos nucleofílicos que normalmente realizan desplazamientos con haluros de alquilo y haluros de arilo activados. Las sustituciones ocurren bajo condiciones forzadas de altas temperaturas o bases muy fuertes. Por ejemplo, el clorobenceno reacciona con solución de hidróxido de sodio a temperaturas cercanas\(340^\text{o}\) y esta reacción fue una vez un proceso comercial importante para la producción de bencenol (fenol):
Además, los cloruros, bromuros y yoduros de arilo pueden convertirse en arenaminas\(\ce{ArNH_2}\) por las bases conjugadas de aminas. De hecho, la reacción de la amida potásica con bromobenceno es extremadamente rápida, incluso a temperaturas tan bajas como\(-33^\text{o}\) con amoníaco líquido como disolvente:
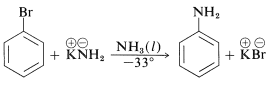
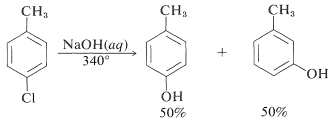
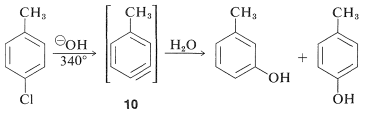
Sin embargo, las reacciones de desplazamiento de este tipo difieren de los desplazamientos previamente discutidos de haluros de arilo activados en que a menudo se produce un reordenamiento. Es decir, el grupo entrante no siempre ocupa la misma posición en el anillo que la desocupada por el sustituyente halógeno. Por ejemplo, la hidrólisis de 4-clorometilbenceno\(340^\text{o}\) da una mezcla equimolar de 3- y 4-metilbencenoles:
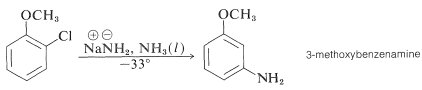
Aún más llamativa es la formación exclusiva de 3-metoxibencenamina en la aminación de 2-clorometoxibenceno. Observe que este resultado es una violación del principio de menor cambio estructural (Sección 1-1H):
El mecanismo de este tipo de reacción ha sido estudiado extensamente, y se han acumulado muchas pruebas en apoyo de un proceso paso a paso, que procede primero mediante la eliminación catalizada por base del haluro\(\left( \ce{HX} \right)\) de hidrógeno del haluro de arilo, como se ilustra a continuación para la aminación del bromobenceno:
Eliminación
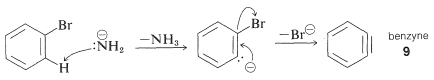
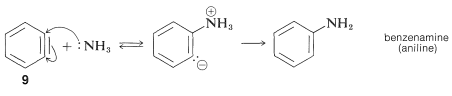
El producto de la reacción de eliminación es un intermedio altamente reactivo\(9\) llamado benzino, o deshidrobenceno, que difiere del benceno en tener dos menos hidrógeno y un enlace extra entre dos orto carbonos. El benzino reacciona rápidamente con cualquier nucleófilo disponible, en este caso el disolvente, amoníaco, para dar un producto de adición:
Adición
Los reordenamientos en estas reacciones resultan de la reacción del nucleófilo en uno u otro de los carbonos del enlace extra en el intermedio. Con el benzino la simetría es tal que no se detectaría ningún reordenamiento. Con benzinas sustituidas pueden resultar productos isoméricos. Así, 4-metilbenzino\(10\), a partir de la reacción del ion hidróxido con 4-cloro-1-metilbenceno da tanto 3- como 4-metilbencenoles:
En las reacciones bencinas anteriores la base que produce el benzino en la etapa de eliminación se deriva del nucleófilo que se añade en la etapa de adición. Esto no siempre tiene que ser así, dependiendo de las condiciones de reacción. De hecho, la utilidad sintética de las reacciones de arino depende en gran parte del éxito con el que el arino puede ser generado por un reactivo pero capturado por otro. Uno de tales métodos se discutirá en la Sección 14-10C e implica compuestos organometálicos derivados de haluros de arilo. Otro método es generar el arino por descomposición térmica de un compuesto de areno 1,2-disustituido tal como\(11\), en el que ambos sustituyentes son grupos lábil - uno que sale con un par de electrones, el otro dejando sin:
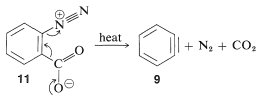
Cuando se\(11\) descompone en presencia de un nucleófilo agregado, el intermedio bencino es atrapado por el nucleófilo a medida que se forma. O bien, si está presente un dieno conjugado, el benzino reaccionará con él mediante una cicloadición [4 + 2]. En ausencia de otros compuestos con los que pueda reaccionar, el benzino sufrirá [2 + 2] cicloadición a sí mismo:
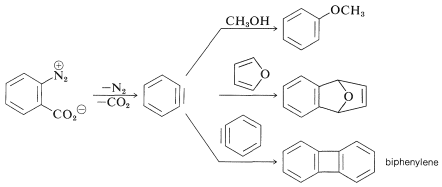
Ejercicio
25. Cuando el p-clorotolueno reacciona con NaOH, se observan dos productos. Mientras que cuando el m-clorotolueno reacciona con NaOH, se observan tres productos. Explique esto.
- Contestar
-
25. Es necesario mirar los intermedios de benzino. El para sustituido sólo permite dos productos, mientras que el para produce dos alquinos diferentes que dan tres productos diferentes.

Colaboradores y Atribuciones
Dr. Dietmar Kennepohl FCIC (Professor of Chemistry, Athabasca University)
Prof. Steven Farmer (Sonoma State University)
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."

