18.10: Sustitución aromática nucleofílica - El Mecanismo de Adición-Elimanción
- Page ID
- 76088
Reacciones de desplazamiento aromático nucleofílico de haluros de arilo
Los enlaces carbono-halógeno de los haluros de arilo son como los de los haluros de alquenil al ser mucho más fuertes que los de los haluros de alquilo. Los haluros de arilo simples generalmente son resistentes a la reacción con nucleófilos en reacciones de S N 1 o S N 2. Sin embargo, esta baja reactividad puede cambiarse drásticamente por cambios en las condiciones de reacción y la estructura del haluro de arilo. De hecho, el desplazamiento nucleofílico se vuelve bastante rápido
- cuando el haluro de arilo se activa por sustitución con grupos fuertemente atrayentes de electrones tales como N2, y
- cuando se utilizan reactivos nucleofílicos muy básicos.
Mecanismo de Adición-Eliminación de la Sustitución Nucleofílica de Halidos de Arilo
Aunque los haluros de arilo simples son inertes a los reactivos nucleofílicos habituales, se produce una activación considerable por sustituyentes fuertemente atrayentes de electrones siempre que estos se localicen en las posiciones orto o para, o en ambas. Por ejemplo, el desplazamiento del ion cloruro del 1-cloro-2,4-dinitrobenceno por la dimetilamina ocurre fácilmente en solución de etanol a temperatura ambiente. Bajo las mismas condiciones el clorobenceno no reacciona completamente; así la influencia activadora de los dos grupos nitro asciende a un factor de al menos 108:
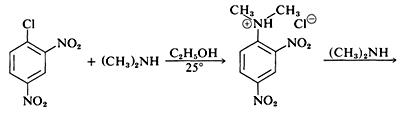
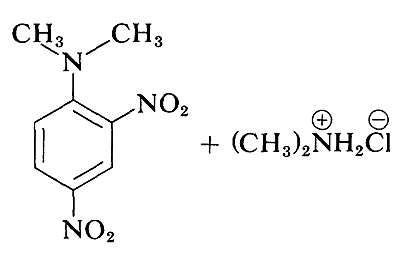
En general, las reacciones de haluros de arilo activados se asemejan mucho a las reacciones de desplazamiento S N 2 de haluros alifáticos. Los mismos reactivos nucleofílicos son efectivos (e.g., CH 3 O -, HO - y RNH 2); las reacciones son de segundo orden global (primer orden en haluro y primer orden en nucleófilo); y para un haluro dado cuanto más fuerte es el nucleófilo, más rápida es la reacción. Sin embargo, debe haber más que una sutil diferencia en el mecanismo debido a que un haluro de arilo es incapaz, de pasar por el mismo tipo de estado de transición que un haluro de alquilo en desplazamientos de S N 2.
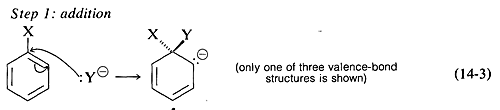
El mecanismo generalmente aceptado de sustitución aromática nucleófila de haluros de arilo portadores de grupos activadores implica dos etapas que son muy análogas a las descritas para haluros de alquinilo y alquinilo. El primer paso implica que el nucleófilo Y: - reaccione con el carbono que porta el sustituyente halógeno para formar un carbanión intermedio (Ecuación 14-3). El sistema aromático se destruye al formar el anión, y el carbono en el sitio de reacción cambia de plano (enlaces sp 2) a tetraédrico (enlaces sp 3).
En el segundo paso, la pérdida de un anión, X - o Y -, regenera un sistema aromático. Si se pierde X -, la reacción global es el desplazamiento nucleofílico de X por Y. En el caso de un reactivo nucleófilo neutro, Y o HY, la secuencia de reacción sería la misma excepto por los ajustes necesarios en la carga del intermedio:
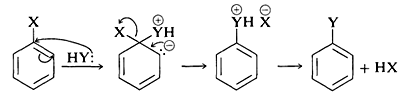
¿Por qué esta vía de reacción es generalmente desfavorable para los haluros de arilo simples? La respuesta es que el intermedio aniónico es demasiado alto en energía para formarse a cualquier tasa práctica. No solo el anión ha perdido la estabilización aromática del anillo de benceno, sino que su formación da como resultado la transferencia de carga negativa a los carbonos del anillo, que en sí mismos no son muy electronegativos:
Sin embargo, cuando se localizan grupos fuertemente atrayentes de electrones en el anillo en las posiciones orto-para, el anión intermedio se estabiliza por deslocalización de electrones de los carbonos del anillo a ubicaciones más favorables en los grupos sustituyentes. Como ejemplo, considere el desplazamiento de bromo por - OCH 3 en la reacción del 4-bromonitrobenceno y el ion metóxido:
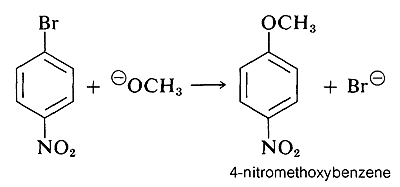
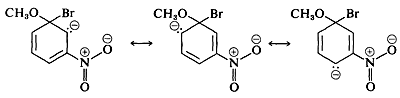
El intermedio aniónico formado por adición de ion metóxido al haluro de arilo puede describirse mediante las estructuras de enlace de valencia 5a-5d. De estas estructuras 5d es especialmente importante porque la carga se transfiere desde los carbonos del anillo al oxígeno electronegativo del sustituyente nitro:
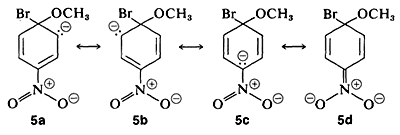
Los sustituyentes en las posiciones meta tienen mucho menos efecto sobre la reactividad de un haluro de arilo porque no es posible la deslocalización de electrones al sustituyente. No se pueden escribir fórmulas análogas a 5c y 5d en las que las cargas negativas están ambas en átomos próximos al nitrógeno positivo,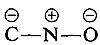 y
y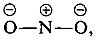
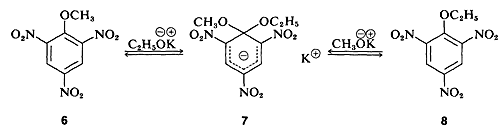
En algunos casos, se han aislado compuestos estables que se asemejan al intermedio de reacción postulado. Un ejemplo clásico es el complejo 7 (aislado por J. Meisenheimer), que es el producto de la reacción del metil aril éter 6 con etóxido de potasio, o el etil aril éter 8 y metóxido de potasio:
Ejercicio
24. Proponer un mecanismo para la siguiente reacción:

- Responder
-
24.

Colaboradores y Atribuciones
Dr. Dietmar Kennepohl FCIC (Professor of Chemistry, Athabasca University)
Prof. Steven Farmer (Sonoma State University)
William Reusch, Professor Emeritus (Michigan State U.), Virtual Textbook of Organic Chemistry
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."

